Diyabet Tedavisi için Eksubera
Marka Adı: Exubera
Jenerik Adı: insülin insan
Dozaj Formu: inhalasyon tozu
İçindekiler:
Açıklama
Klinik Farmakoloji
Klinik çalışmalar
Göstergeler ve kullanımları
Kontrendikasyonlar
Uyarılar
Önlemler
İlaç etkileşimleri
Ters tepkiler
Doz Aşımı
Dozaj ve Uygulama
Nasıl tedarik edildi
Exubera, insülin insanı [rDNA kökenli] Hasta bilgisi (Sade ingilizce)
Açıklama
Exubera® Exubera kullanılarak verilen insan insülin inhalasyon tozunu içeren kabarcıklardan oluşur® İnhaler. Exubera kabarcıklar, Escherichia coli'nin (K12) patojenik olmayan bir laboratuvar suşunu kullanarak rekombinant DNA teknolojisi ile üretilen insan insülini içerir. Kimyasal olarak, insan insülini ampirik formül C'ye sahiptir.257'H383N-65Ö77S6 ve 5808 molekül ağırlığı. İnsan insülini aşağıdaki primer amino asit sekansına sahiptir:

Exubera (insülin insanı [rDNA kökenli]) Soluma Toz, birim doz blisterde beyaz ila kirli beyaz bir tozdur (dolgu kütlesi, bkz. Tablo 1). Exubera'nın her birim doz blisterinde, 1 mg veya 3 mg insülin dozu (bkz. Tablo 1) sodyum sitrat (dihidrat), mannitol, glisin ve sodyum içeren homojen toz formülasyonu hidroksit. İnhalatöre bir Exubera blister sokulduktan sonra, hasta inhalerin kolunu pompalar ve ardından bir düğmeye basar ve blister delinir. İnsülin inhalasyon tozu daha sonra hazneye dağıtılır ve hastanın aerosol haline getirilmiş tozu solumasını sağlar.
Standartlaştırılmış in vitro test koşulları altında Exubera, inhalerin ağızlığından belirli bir yayılan insülin dozu verir (bakınız Tablo 1). Toplam parçacık kütlesinin bir kısmı, derin akciğere ulaşabilen ince parçacıklar olarak yayılır. 1 mg blister içeriğinin% 45'ine kadar ve 3 mg blister içeriğinin% 25'ine kadar blisterde tutulabilir.
Tablo 1: Doz Adlandırması ve Bilgileri
| Dolgu Kütlesi (mg tozu) |
Nominal Doz (mg insülin) |
Yayılan Doz*,†(mg insülin) |
İnce Partikül Dozuc,†(mg insülin) |
|---|---|---|---|
| |||
| 1.7 | 1.0 | 0.53 | 0.4 |
| 5.1 | 3.0 | 2.03 | 1.0 |
Akciğere verilen gerçek insülin miktarı inspiratuar akış profili gibi bireysel hasta faktörlerine bağlı olacaktır. İn vitro olarak, yayılan aerosol metrikleri 10 L / dk'nın üzerindeki akış hızlarından etkilenmez.
üst
Klinik Farmakoloji
Hareket mekanizması
İnsülinin birincil aktivitesi glikoz metabolizmasının düzenlenmesidir. İnsülin, iskelet kası ve yağ tarafından periferal glikoz alımını uyararak ve hepatik glikoz üretimini engelleyerek kan şekeri konsantrasyonlarını düşürür. İnsülin adipositte lipolizi inhibe eder, proteolizi inhibe eder ve protein sentezini arttırır.
Farmakokinetik
emme
Exubera, insülini oral inhalasyon yoluyla sağlar. İnsülin deri altından uygulanan hızlı etkili insülin analogları kadar hızlı ve daha hızlı emilir. sağlıklı kişilerde ve tip 1 veya tip 2 diyabetli hastalarda deri altından düzenli insan insülini uygulanır (bkz. Şekil 1).
Şekil 1: Aşağıdaki Tip 2 Diyabetli Hastalarda Serbest İnsülin Serum Konsantrasyonlarındaki (µU / mL) Ortalama Değişiklikler Exubera (6 mg) ve Subkütan Düzenli İnsan İnsülinden Tekli İnhale İnsülin Uygulaması (18U)
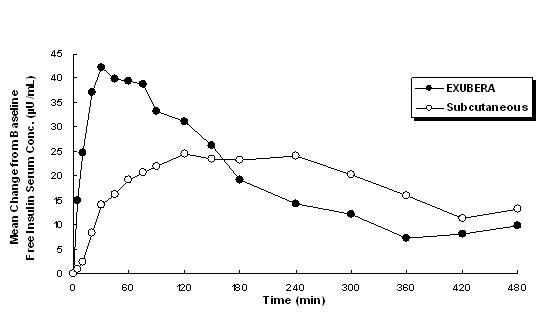
Tip 1 ve tip 2 diyabetli hastalarda yapılan klinik çalışmalarda, Exubera solunduktan sonra serum insülin pik konsantrasyonuna göre daha hızlı ulaştı düzenli insan insülininin deri altına enjeksiyonundan sonra, 105 dakikaya (60 ila 240 dakika arasında) kıyasla 49 dakika (aralık 30 ila 90 dakika), sırasıyla.
Klinik çalışmalarda, subkutan düzenli insan insülinin emilimi, artan hasta vücut kitle indeksi (VKİ) ile azalmıştır. Bununla birlikte, Exubera'nın solunmasının ardından insülin emilimi BMI'dan bağımsızdı.
Sağlıklı kişilerde yapılan bir çalışmada, aşağıdakilerin uygulanmasını takiben sistemik insülin maruziyeti (AUC ve Cmax) Exubera, 1 ve 3 mg'lık kombinasyonlar halinde uygulandığında 1 ila 6 mg aralığında dozla arttı kabarcıklar.
Üç 1 mg'lık kabarcıkların dozaj formunun, uygulamadan sonra bir 3 mg'lık kabarcıklar, Cmax ve AUC ile karşılaştırıldığı bir çalışmada 1 mg'lık üç kabarcık, 3 mg'lık bir blister uygulamasından sonra sırasıyla yaklaşık% 30 ve% 40 daha büyüktü (bkz. KULLANIM ŞEKLİ VE DOZU).
Dağıtım ve Eliminasyon
Rekombinant insan insülini endojen insülin ile aynı olduğundan, sistemik dağılım ve eliminasyonun aynı olması beklenir. Ancak bu Exubera için doğrulanmadı.
Farmakodinamik
Eksubera, deri altından uygulanan hızlı etkili insülin analogları gibi, deri altından uygulanan normal insan insülininden daha hızlı bir glikoz düşürücü aktiviteye başlar. Sağlıklı gönüllülerde, Exubera için glikoz düşürücü aktivitenin süresi deri altı ile karşılaştırılabilirdi düzenli insan insülini uygulandı ve deri altı uygulanan hızlı etkili insülin analoglarından daha uzun (bkz. Şekil 2).
şekil 2. Ortalama Glikoz İnfüzyon Oranı (GIR)maksimum Gönüllülerde Zamana Karşı Her Denek Tedavisi
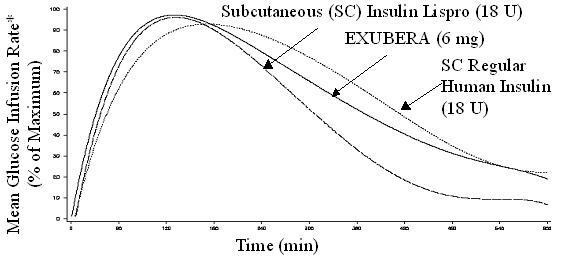
* Sabit plazma glikoz konsantrasyonlarını korumak için infüze edilen ve maksimum değerlere normalize edilen (maksimum değerlerin yüzdesi) glikoz miktarı olarak belirlenir; insülin aktivitesinin göstergesi.
Exubera solunduğunda, sağlıklı gönüllülerde glikoz düşürücü aktivitenin başlangıcı 10-20 dakika içinde ortaya çıkar. Glikoz düşürme üzerindeki maksimum etki, inhalasyondan yaklaşık 2 saat sonra uygulanır. Glikoz düşürücü aktivitenin süresi yaklaşık 6 saattir.
Tip 1 veya tip 2 diyabetli hastalarda, Exubera, subkutan olarak verilen normal insan insülinine kıyasla dozlamadan sonraki ilk iki saat içinde daha büyük glikoz düşürücü etkiye sahiptir.
Exubera'nın glikoz düşürücü aktivitesinin denek içi değişkenliği genellikle tip 1 ve 2 diyabetli hastalarda subkütan olarak uygulanan normal insan insüliniyle karşılaştırılabilir.
Özel Nüfuslar
Pediyatrik hastalar
Tip 1 diyabetli çocuklarda (6-11 yaş) ve ergenlerde (12-17 yaş), Exubera için zirve insülin konsantrasyonuna kadar geçen süre Tip 1 erişkin hastalarda gözlemlerle tutarlı olan subkutan düzenli insan insülininden daha hızlı elde edildi diyabet.
Geriatrik Hastalar
65 yaşın üzerindeki hastalarla genç erişkin hastaları karşılaştırırken Exubera'nın farmakokinetik özelliklerinde belirgin bir fark yoktur.
Cinsiyet
Diyabetli ve diyabeti olmayan hastalarda, Exubera'nın farmakokinetik özelliklerinde erkekler ve kadınlar arasında belirgin bir fark gözlenmemiştir.
Yarış
25 sağlıklı Kafkas ve Japon diyabetik olmayan denek üzerinde bir çalışma yapılmıştır. Exubera'nın farmakokinetik ve farmakodinamik özellikleri, normal insanın subkutan enjeksiyonuna karşı İnsülin. Exubera'nın farmakokinetik ve farmakodinamik özellikleri, iki popülasyon arasında benzerdi.
şişmanlık
Exubera'nın emilimi hasta BMI'sından bağımsızdır.
Böbrek yetmezliği
Böbrek yetmezliğinin Exubera'nın farmakokinetiği üzerindeki etkisi araştırılmamıştır. Böbrek fonksiyon bozukluğu olan hastalarda dikkatli glikoz izleme ve insülin doz ayarlaması gerekebilir (bkz. ÖNLEMLER, Böbrek yetmezliği).
Karaciğer yetmezliği
Karaciğer yetmezliğinin Exubera'nın farmakokinetiği üzerindeki etkisi araştırılmamıştır. Karaciğer fonksiyon bozukluğu olan hastalarda dikkatli glikoz izleme ve insülin doz ayarlaması gerekebilir (bkz. ÖNLEMLER).
Gebelik
Exubera'nın gestasyonel ve pre-gestasyonel tip 2 diyabetli gebe hastalarda emilimi, tip 2 diyabetli gebe olmayan hastalarda emilim ile uyumlu idi (bkz. ÖNLEMLER).
Sigara içmek
Sigara içenlerde, Exubera için sistemik insülin maruziyetinin sigara içmeyenlere göre 2 ila 5 kat daha yüksek olması beklenmektedir. Exubera, Exubera tedavisine başlamadan 6 aydan daha kısa bir süre önce sigara içen veya sigarayı bırakan hastalarda kontrendikedir. Bir hasta sigara içmeye başlarsa veya devam ettirirse, artan hipoglisemi riski nedeniyle Exubera derhal kesilmeli ve alternatif bir tedavi uygulanmalıdır (bkz. KONTRENDİKASYONLARI).
Exubera'nın 69'u (69'u sigara içen) klinik çalışmalarında, sigara içenler daha hızlı bir glikoz düşürücü etki başlamış, daha fazla maksimum etki ve daha büyük bir toplam glikoz düşürücü etki (özellikle dozlamadan sonraki ilk 2-3 saat içinde) ile karşılaştırıldığında sigara içmeyenler.
Pasif Sigara Dumanı
Aktif sigara içildikten sonra insülin maruziyetindeki artışın aksine, Exubera 2 sağlıklı sigara içmeyen gönüllüye 2 yaşından sonra uygulandığında kontrollü bir deney ortamında pasif sigara dumanına maruz kalma saatleri, insülin EAA ve Cmax yaklaşık% 20 ve% 30 oranında azaltıldı, sırasıyla. Exubera'nın farmakokinetiği, kronik olarak pasif sigara dumanına maruz kalan sigara içmeyenlerde araştırılmamıştır.
Altta Akciğer Hastalığı Olan Hastalar
Exubera'nın astım veya KOAH gibi altta yatan akciğer hastalığı olan hastalarda kullanılması önerilmez, çünkü bu popülasyonda Exubera'nın güvenliği ve etkinliği belirlenmemiştir (bkz. UYARILAR). Exubera kullanımı dengesiz veya kötü kontrol edilen akciğer hastalığı olan hastalarda kontrendikedir, çünkü geniş Exubera'nın emilimini etkileyebilecek ve hipoglisemi riskini artırabilecek akciğer fonksiyon değişiklikleri hiperglisemi (bkz. KONTRENDİKASYONLARI).
Hafif astımlı 24 diyabetik olmayan denek üzerinde yapılan bir farmakokinetik çalışmada, Exubera, bronkodilatör ile tedavi olmadığında, olmayan hastalarda görülen emilimden yaklaşık% 20 daha düşüktü. astım. Bununla birlikte, Kronik Obstrüktif Akciğer Hastalığı (KOAH) olan diyabetik olmayan 24 kişide yapılan bir çalışmada, sistemik Exubera uygulamasını takiben maruz kalma, normal kişilerdekinden yaklaşık iki kat daha yüksekti KOAH (bkz. ÖNLEMLER).
Hafif astım (n = 36) ve orta şiddette diyabetik olmayan hastalara Exubera verilmesinden 30 dakika önce albuterol uygulanması astım (n = 31), Exubera'nın tek başına uygulandığı zamana kıyasla insülin EAA ve Cmax'ta ortalama% 25 ila 50 arasında bir artışla sonuçlandı (bkz. ÖNLEMLER).
üst
Klinik çalışmalar
Exubera'nın güvenliği ve etkinliği, tip 1 ve tip 2 diyabetli yaklaşık 2500 yetişkin hastada incelenmiştir. Çoğu çalışma için birincil etkinlik parametresi, hemoglobin A1c'deki (HbA1c) başlangıçtaki azalmadan ölçüldüğü gibi glisemik kontrol idi.
Tip 1 Diyabet
Tip 1 diyabetli hastalarda 24 haftalık, randomize, açık etiketli, aktif kontrol çalışması (Çalışma A) yapılmıştır. Exubera, tek bir gece Humulin® U Ultralente® (insan insülin uzatmalı çinko süspansiyonu) enjeksiyonu ile günde üç kez yemek öncesi (TID) uyguladı (n = 136). Karşılaştırıcı tedavi, günde iki kez uygulanan deri altı düzenli insan insülinidir (BID) NPH insan insülininin (insan insülin izofan süspansiyonu) BID enjeksiyonu ile (kahvaltı öncesi ve akşam yemeği öncesi) (n = 132). Bu çalışmada ortalama yaş 38.2 (dağılım: 20-64) idi ve deneklerin% 52'si erkekti.
Tip 1 diyabetli hastalarda, hastalığın değerlendirilmesi için 24 haftalık ikinci bir randomize, açık etiketli, aktif kontrol çalışması (Çalışma B) yapıldı. öncesinde TID uygulandığında subkütan düzenli insan insülinine (n = 103) kıyasla Exubera'nın (n = 103) güvenliği ve etkinliği yemekler. Her iki tedavi kolunda, NPH insan insülini bazal insülin olarak BID (sabah ve yatmadan önce) uygulandı. Bu çalışmada ortalama yaş 38.4 (dağılım: 19-65) idi ve deneklerin% 54'ü erkektir.
Her çalışmada, HbA1c'deki azalma ve hipoglisemi oranları iki tedavi grubu için benzerdi. Eksubera ile tedavi edilen hastalarda açlık plazma glukozunda karşılaştırma grubundaki hastalara göre daha fazla azalma görülmüştür. HbA1c seviyesine
Tablo 2: Tip 1 Diyabetli Hastalarda İki 24 Haftalık Aktif Kontrol, Açık Etiketli Denemelerin Sonuçları (A ve B Çalışmaları)
| Çalışma A | Çalışma B | |||
|---|---|---|---|---|
| Exubera (TID) + UL (QD) | SC R (BID) + NPH (BID) | Eksubera (TID) + NPH (BID) | SC R (TID) + NPH (BID) | |
| Örnek boyut | 136 | 132 | 103 | 103 |
| UL = Humulin® U Ultralente®; SC R = deri altı düzenli insan insülini | ||||
| ||||
| HbA1c (%) | ||||
| Temel ortalama | 7.9 | 8.0 | 7.8 | 7.8 |
| Düzeltilmiş. taban çizgisinden ortalama değişim | -0.2 | -0.4 | -0.3 | -0.2 |
| Eksubera eksi SC R* | 0.14 | -0.11 | ||
| Tedavi farkı için% 95 CI | (-0.03, 0.32) | (-0.30, 0.08) | ||
| Açlık Plazma Glikozu (mg / dL) | ||||
| Temel ortalama | 191 | 198 | 178 | 191 |
| Düzeltilmiş. taban çizgisinden ortalama değişim | -32 | -6 | -23 | 13 |
| Eksubera eksi SC R | -27 | -35 | ||
| Tedavi farkı için% 95 CI | (-47, -6) | (-58, -13) | ||
| 2 saatlik Post-Prandial Glikoz Konsantrasyonu (mg / dL) | ||||
| Temel ortalama | 283 | 305 | 273 | 293 |
| Düzeltilmiş. taban çizgisinden ortalama değişim | -21 | 14 | -1 | -3 |
| Eksubera eksi SC R | -35 | 2 | ||
| Tedavi farkı için% 95 CI | (-61, -8) | (-29, 32) | ||
| Çalışma sonu HbA olan hastalar1c < 8%†| 64.0% | 68.2% | 74.8% | 66.0% |
| Çalışma sonu HbA olan hastalar1c < 7% | 16.9% | 19.7% | 28.2% | 30.1% |
| Vücut ağırlığı | ||||
| Başlangıç ortalaması (kg) | 77.4 | 76.4 | 76.0 | 76.9 |
| Düzeltilmiş. taban çizgisinden ortalama değişim (kg) | 0.4 | 1.1 | 0.4 | 0.6 |
| Eksubera eksi SC R | -0.72 | -0.24 | ||
| Tedavi farkı için% 95 CI | (-1.48, 0.04) | (-1.07, 0.59) | ||
| Çalışma sonu günlük insülin dozu | ||||
| Kısa etkili insülin | 13.4 mgc | 18.3 IU | 10.9 mgc | 25.7 IU |
| Uzun etkili insülin | 26.4 IU | 37.1 IU | 31.5 IU | 31.9 IU |
2 tip diyabet
Diyet ve Egzersiz Tedavisi İle Optimal Kontrollü Olmayan Hastalarda Monoterapi
Tip 2 diyabetli hastalarda optimal olmayan 12 haftalık, randomize, açık etiketli, aktif kontrol çalışması (Çalışma C) yapıldı diyet ve egzersizle kontrol edilen, yemek öncesi TID Exubera'nın (n = 75) güvenliğini ve etkinliğini insülin duyarlılaştırıcı ajan. Bu çalışmada ortalama yaş 53.7 yıl (dağılım: 28-80), deneklerin% 55'i erkek ve ortalama vücut kitle indeksi 32.3 kg / m idi.2.
12. haftada, HbA1c Exubera ile tedavi edilen hastalarda düzeyler% 9.5 (SD = 1.1) bazal seviyeden% 2.2 (SD = 1.0) azaldı. Exubera ile tedavi edilen hastaların çalışma sonu HbA'ya ulaşan oranı1c 1c seviyesi
Oral Ajan Terapisi ile Önceden Tedavi Edilen Hastalarda Monoterapi ve Eklenti Terapisi
Tipik hastalarda 12 haftalık, randomize, açık etiketli, aktif kontrol çalışması (Çalışma D) yapıldı Şu anda tedavi gören ancak kötü kontrol edilen 2 diyabet, iki oral ajan ile (OA). Başlangıç OA'larına bir insülin sekretagogu ve metformin veya bir tiazolidindion dahil edildi. Hastalar üç koldan birine randomize edildi: sadece devam eden OA tedavisine (n = 96), yemek öncesi TID Exubera monoterapisi (n = 102) veya devam eden OA tedavisine yemek öncesi TID Exubera eklenmesi (n = 100). Bu çalışmada ortalama yaş 57.4 (dağılım: 33-80), deneklerin% 66'sı erkek ve ortalama vücut kitle indeksi 30 kg / m idi.2.
Exubera monoterapisi ve OA tedavisi ile birlikte Exubera, HbA'nın azaltılmasında sadece OA tedavisinden daha üstündü1c taban çizgisinden seviyeler. İki Exubera tedavi grubu için hipoglisemi oranları, sadece OA tedavisi grubundan biraz daha yüksekti. Sadece OA tedavisiyle karşılaştırıldığında, HbA'ya ulaşan hastaların yüzdesi1c seviyesi 1c OA tedavisi ile birlikte Exubera monoterapisi ve Exubera ile tedavi edilen hastalarda
Tablo 3: Çift Oral Ajan Tedavisi İle Optimal Kontrollü Olmayan Tip 2 Diyabetli Hastalarda 12 Haftalık Aktif Kontrol, Açık Etiket Denemesinin Sonuçları (Çalışma D)
| Çalışma D | Exubera monoterapisi | OAS* | Exubera + OA'lar |
|---|---|---|---|
| Örnek boyut | 102 | 96 | 100 |
| |||
| HbA1c (%) | |||
| Temel ortalama | 9.3 | 9.3 | 9.2 |
| Düzeltilmiş. taban çizgisinden ortalama değişim | -1.4 | -0.2 | -1.9 |
| Exubera grubu eksi OA'lar†| -1.18†,c, § | -1.67†, ¶, § | |
| Tedavi farkı için% 95 CI | (-1.41, -0.95) | (-1.90, -1.44) | |
| Açlık Plazma Glikozu (mg / dL) | |||
| Temel ortalama | 203 | 203 | 195 |
| Düzeltilmiş. taban çizgisinden ortalama değişim | -23 | 1 | -53 |
| Exubera grubu eksi OA'lar | -24c | -53 ¶ | |
| Tedavi farkı için% 95 CI | (-36, -11) | (-66, -41) | |
| Çalışma sonu HbA olan hastalar1c < 8%# | 55.9% | 18.8% | 86.0% |
| Çalışma sonu HbA olan hastalar1c < 7% | 16.7% | 1.0% | 32.0% |
| Vücut ağırlığı | |||
| Başlangıç ortalaması (kg) | 89.5 | 88.0 | 88.6 |
| Düzeltilmiş. taban çizgisinden ortalama değişim (kg) | 2.8 | 0.0 | 2.7 |
| Exubera grubu eksi OA'lar | 2.80c | 2.75 ¶ | |
| Tedavi farkı için% 95 CI | (1.94, 3.65) | (1.89, 3.61) |
Halen sulfonilüre tedavisi alan tip 2 diyabetli hastalarda 24 haftalık, randomize, açık etiketli, aktif kontrol çalışması (Çalışma E) gerçekleştirilmiştir. Bu çalışma devam etmek için yemek öncesi Exubera ilavesinin güvenliğini ve etkinliğini değerlendirmek üzere tasarlanmıştır. sulfonilüre tedavisine (n = 214) devam eden sülfonilüre tedavisine yemek öncesi metformin ilavesiyle karşılaştırıldığında (n = 196). Denekler -1. Haftada HbA1c değerlerine göre sınıflandırıldı. İki tabaka tanımlanmıştır: düşük bir HbA1c tabakası (HbA1c â ‰ ¥ 8 ila â ‰ ¤9,5) ve yüksek HbA1c tabaka (HbA1c > 9.5 ila
Sülfonilüre ile kombinasyon halinde exubera, yüksek stratum grubundaki taban çizgisinden HbA1c değerlerini düşürmede metformin ve sülfonilüre'den daha üstündür. Sülfonilüre ile kombinasyon halinde exubera, düşük stratum grubundaki taban çizgisinden HbA1c değerlerinin düşürülmesinde sülfonilüre ile kombinasyon halinde metformin ile karşılaştırılabilir. Sülfonilüre'ye Exubera ilave edildikten sonra hipoglisemi oranı, sülfonilüre'ye metformin ilave edilmesinden daha yüksekti. Hedef HbA1c değerlerine% 8 ve% 7 ulaşan hastaların yüzdesi, açlık plazma glikozundaki azalma gibi her iki tabakadaki tedavi grupları arasında benzerdi (bkz. Tablo 4).
Halen metformin tedavisi alan tip 2 diyabetli hastalarda 24 haftalık başka bir randomize, açık etiketli, aktif kontrol çalışması (Çalışma F) gerçekleştirildi. Bu çalışma devam etmek için yemek öncesi Exubera ilavesinin güvenliğini ve etkinliğini değerlendirmek üzere tasarlanmıştır. Metformin tedavisine (n = 234) devam eden metformin tedavisine yemek öncesi glibenklamid ilavesiyle karşılaştırıldığında (n = 222). Bu çalışmadaki denekler ayrıca Çalışma E'de tanımlandığı gibi iki tabakadan birine katmanlaştırılmıştır.
Metformin ile kombinasyon halinde exubera, HbA'nın azaltılmasında glibenklamid ve metforminden daha üstündü1c taban çizgisinden ve hedef HbA'ya ulaşan değerler1c yüksek stratum grubundaki değerler. Metformin ile kombinasyon halinde exubera, HbA'nın azaltılmasında metformin ile kombinasyon halinde glibenklamid ile karşılaştırılabilir1c taban çizgisinden ve hedef HbA'ya ulaşan değerler1c düşük stratum grubundaki değerler. Exubera metformine ilave edildikten sonra hipoglisemi oranı, metformine glibenklamid ilave edildikten sonra biraz daha yüksekti. Açlık plazma glikozunda azalma tedavi grupları arasında benzerdi (bkz. Tablo 4).
Tablo 4: Daha Önce Oral Ajan Terapisinde Tip 2 Diyabetli Hastalarda İki 24 Haftalık Aktif Kontrol, Açık Etiket Denemelerinin Sonuçları (Çalışma E ve F)
| Çalışma E | Çalışma F | |||||||
|---|---|---|---|---|---|---|---|---|
| Exubera + SU* | Tanışmak*+ SU* | Exubera + SU* | Tanışmak*+ SU* | Exubera + Met* | Gli* + Tanıştı* | Exubera + Met* | Gli* + Tanıştı* | |
| Yüksek tabaka†| Düşük tabaka†| Yüksek tabaka†| Düşük tabaka†| |||||
| Örnek boyut | 113 | 103 | 101 | 93 | 109 | 103 | 125 | 119 |
| ||||||||
| HbA1c (%) | ||||||||
| Temel ortalama | 10.5 | 10.6 | 8.8 | 8.8 | 10.4 | 10.6 | 8.6 | 8.7 |
| Düzeltilmiş. taban çizgisinden ortalama değişim | -2.2 | -1.8 | -1.9 | -1.9 | -2.2 | -1.9 | -1.8 | -1.9 |
| Exubera eksi OAc | -0.38c, § | -0.07 | -0.37c, ¶ | 0.04 | ||||
| Tedavi farkı için% 95 CI | (-0.63, -0.14) | (-0.33, 0.19) | (-0.62, -0.12) | (-0.19, 0.27) | ||||
| Açlık Plazma Glikozu (mg / dL) | ||||||||
| Temel ortalama | 241 | 237 | 197 | 198 | 223 | 243 | 187 | 196 |
| Taban çizgisinden ortalama değişim | -46 | -47 | -48 | -52 | -42 | -40 | -46 | -49 |
| Exubera eksi OA | 1 | 4 | -2 | 4 | ||||
| Tedavi farkı için% 95 CI | (-11, 12) | (-8, 16) | (-14, 10) | (-7, 15) | ||||
| Çalışma sonu HbA olan konular1c < 8%# | 48.7% | 44.7% | 81.2% | 73.1% | 72.5% | 56.3% | 80.8% | 86.6% |
| Çalışma sonu HbA olan konular1c < 7% | 20.4% | 14.6% | 30.7% | 32.3% | 33.9% | 17.5% | 40.0% | 42.9% |
| Vücut ağırlığı | ||||||||
| Başlangıç ortalaması (kg) | 80.8 | 79.5 | 79.9 | 81.9 | 88.3 | 87.8 | 90.3 | 88.2 |
| Düzeltilmiş. taban çizgisinden ortalama değişim (kg) | 3.6 | -0.0 | 2.4 | -0.3 | 2.8 | 2.5 | 2.0 | 1.6 |
| Exubera eksi OA | 3.60 | 2.67 | 0.26 | 0.38 | ||||
| Tedavi farkı için% 95 CI | (2.81, 4.39) | (1.84, 3.51) | (-0.70, 1.21) | (-0.52, 1.27) |
Daha Önce Subkütan İnsülin ile Tedavi Edilen Hastalarda Kullanım
Tip 2 olan insülin ile tedavi edilen hastalara 24 haftalık, randomize, açık etiketli, aktif kontrol çalışması (Çalışma G) uygulandı tek bir gece enjeksiyon ile Exubera verilen yemek öncesi TID güvenliğini ve etkinliğini değerlendirmek için diyabet Humulin®® U Ultralente® (n = 146) NPH insan insülininin BID enjeksiyonuyla (n = 149) BID (kahvaltı öncesi ve akşam yemeği öncesi) uygulanan deri altı düzenli insan insülinine kıyasla (n = 149). Bu çalışmada ortalama yaş 57.5 (dağılım: 23-80), deneklerin% 66'sı erkek ve ortalama vücut kitle indeksi 30.3 kg / m idi.2.
HbA'da taban çizgisinden azalmalar1cHbA'ya ulaşan hastaların yüzdesi1c seviyesi 1c
Tablo 5: Önceden Subkütan İnsülin ile Tedavi Edilen Tip 2 Diyabetli Hastalarda 24 Haftalık Aktif Kontrol, Açık Etiketli Denemenin Sonuçları (Çalışma G)
| Çalışma G | Exubera (TID) + UL (QD) | SC R (BID) + NPH (BID) |
|---|---|---|
| Örnek boyut | 146 | 149 |
| UL = Humulin® U Ultralente®; SC R = deri altı düzenli insan insülini | ||
| ||
| HbA1c (%) | ||
| Temel ortalama | 8.1 | 8.2 |
| Düzeltilmiş. taban çizgisinden ortalama değişim | -0.7 | -0.6 |
| Eksubera eksi SC R* | -0.07 | |
| Tedavi farkı için% 95 CI | (-0.31, 0.17) | |
| Açlık Plazma Glikozu (mg / dL) | ||
| Temel ortalama | 152 | 159 |
| Düzeltilmiş. taban çizgisinden ortalama değişim | -22 | -6 |
| Eksubera eksi SC R | -16.36 | |
| Tedavi farkı için% 95 CI | (-27.09, -5.36) | |
| Çalışma sonu HbA olan hastalar1c < 8%†| 76.0% | 69.1% |
| Çalışma sonu HbA olan hastalar1c < 7% | 45.2% | 32.2% |
| Vücut ağırlığı | ||
| Başlangıç ortalaması (kg) | 90.6 | 89.0 |
| Düzeltilmiş. taban çizgisinden ortalama değişim (kg) | 0.1 | 1.3 |
| Eksubera eksi SC R | -1.28 | |
| Tedavi farkı için% 95 CI | (-1.96, -0.60) | |
| Çalışma sonu günlük insülin dozu | ||
| Kısa etkili insülin | 16.6 mgc | 25.5 IU |
| Uzun etkili insülin | 37.9 IU | 52.3 IU |
üst
Göstergeler ve kullanımları
Exubera, hipergliseminin kontrolü için diabetes mellituslu yetişkin hastaların tedavisi için endikedir. Exubera, hızlı etkili insülin analoglarına benzer bir etki başlangıcına sahiptir ve deri altından uygulanan düzenli insan insülinine benzer bir glikoz düşürücü aktiviteye sahiptir. Tip 1 diyabetli hastalarda, daha uzun etkili insülin içeren rejimlerde Exubera kullanılmalıdır. Tip 2 diyabetli hastalarda Exubera, monoterapi olarak veya oral ajanlar veya daha uzun etkili insülinler ile kombinasyon halinde kullanılabilir.
üst
Kontrendikasyonlar
Exubera, Exubera veya eksipiyanlarından birine aşırı duyarlı hastalarda kontrendikedir.
Exubera, Exubera tedavisine başlamadan 6 aydan daha kısa bir süre önce sigara içen veya sigarayı bırakan hastalarda kontrendikedir. Bir hasta sigara içmeye başlarsa veya devam ettirirse, artan hipoglisemi riski nedeniyle Exubera derhal kesilmeli ve alternatif bir tedavi uygulanmalıdır (bkz. KLİNİK FARMAKOLOJİ, Özel Nüfus, Sigara). Sigara içen hastalarda Exubera'nın güvenliği ve etkinliği belirlenmemiştir.
Exubera, dengesiz veya kötü kontrol edilen akciğer hastalığı olan hastalarda, geniş varyasyonlar nedeniyle kontrendikedir Exubera'nın emilimini etkileyebilecek ve hipoglisemi riskini artırabilecek akciğer fonksiyonlarında veya hiperglisemi.
üst
Uyarılar
Exubera, hızlı hareket başlangıcı ile normal insan insülinden farklıdır. Yemek zamanı insülin olarak kullanıldığında, Exubera'nın dozu, yemekten 10 dakika önce verilmelidir.
Hipoglisemi, Exubera dahil olmak üzere insülin tedavisinin en sık bildirilen advers olayıdır. Hipogliseminin zamanlaması çeşitli insülin formülasyonları arasında farklılık gösterebilir.
Tip 1 diyabetli hastalar da yeterli glikoz kontrolünü sağlamak için daha uzun etkili bir insülin gerektirir.
Herhangi bir insülin değişikliği dikkatle ve sadece tıbbi gözetim altında yapılmalıdır. İnsülin mukavemeti, üretici, tip (örn. Düzenli, NPH, analoglar) veya türlerdeki (hayvan, insan) değişiklikler dozajda bir değişikliğe ihtiyaç duyulmasına neden olabilir. Eşzamanlı oral antidiyabetik tedavinin ayarlanması gerekebilir.
Diyabetli tüm hastalar için glikoz izleme önerilir.
Exubera'nın solunum fonksiyonu üzerindeki etkisi nedeniyle, tüm hastaların Exubera ile tedaviye başlamadan önce solunum fonksiyonlarının değerlendirilmesi gerekir (bkz. ÖNLEMLER: Pulmoner fonksiyon).
Exubera'nın astım veya KOAH gibi altta yatan akciğer hastalığı olan hastalarda kullanılması önerilmez, çünkü bu popülasyonda Exubera'nın güvenliği ve etkinliği belirlenmemiştir (bkz. ÖNLEMLER: Altta yatan Akciğer Hastalığı).
Exubera'nın klinik çalışmalarında, Exubera ile tedavi edilen hastalar arasında 6 yeni teşhis edilen primer akciğer malignitesi vakası ve karşılaştırıcı ile tedavi edilen hastalar arasında 1 yeni teşhis edilen vaka vardır. Ayrıca Exubera ile tedavi edilen bir hastada primer akciğer malignitesinin 1 pazarlama sonrası raporu da vardır. Exubera'nın kontrollü klinik çalışmalarında, 100 hasta-yıllık çalışma ilacı maruziyeti başına yeni birincil akciğer kanseri insidansı 0.13 idi. Exubera ile tedavi edilen hastalar için (3900 hasta yılı boyunca 5 vaka) ve karşılaştırıcı ile tedavi edilen hastalar için 0.02 (4100 hasta yılı üzerinde 1 vaka). Bu olayların ortaya çıkışının Exubera ile ilişkili olup olmadığını belirlemek için çok az vaka vardı. Akciğer kanseri teşhisi konan tüm hastalarda önceden sigara içimi öyküsü vardı.
üst
Önlemler
Genel
Tüm insülin preparatlarında olduğu gibi, Exubera etkisinin zaman süreci farklı bireylerde veya aynı bireyde farklı zamanlarda değişebilir. Hastalar fiziksel aktivitelerini veya normal yemek planlarını değiştirirse, herhangi bir insülin dozajının ayarlanması gerekebilir. İnsülin gereklilikleri hastalık, duygusal rahatsızlıklar veya stres gibi ara akım koşullarında değiştirilebilir.
hipoglisemi
Tüm insülin preparatlarında olduğu gibi, hipoglisemik reaksiyonlar Exubera'nın uygulanmasıyla ilişkili olabilir. Serum glikoz konsantrasyonlarındaki hızlı değişiklikler, glikoz değerinden bağımsız olarak diyabetli kişilerde hipoglisemiye benzer semptomlara neden olabilir. Hipogliseminin erken uyarı semptomları, uzun gibi belirli koşullar altında farklı veya daha az belirgin olabilir diyabet süresi, diyabetik sinir hastalığı, beta-blokerler veya yoğun diyabet kontrolü gibi ilaçların kullanımı (görmek ÖNLEMLER: İlaç etkileşimleri). Bu gibi durumlar, hastaların hipoglisemi hakkında farkında olmadan önce ciddi hipoglisemi (ve muhtemelen bilinç kaybı) ile sonuçlanabilir.
Böbrek yetmezliği
Böbrek yetmezliği olan hastalarda çalışma yapılmamıştır. Diğer insülin preparatlarında olduğu gibi, böbrek yetmezliği olan hastalarda Exubera için doz gereksinimleri azaltılabilir (bkz. KLİNİK FARMAKOLOJİ, Özel Nüfuslar).
Karaciğer yetmezliği
Karaciğer yetmezliği olan hastalarda çalışma yapılmamıştır. Diğer insülin preparatlarında olduğu gibi, karaciğer yetmezliği olan hastalarda Exubera için doz gereksinimleri azaltılabilir (bkz. KLİNİK FARMAKOLOJİ, Özel Nüfuslar).
Alerji
Sistemik Alerji
Klinik çalışmalarda, Exubera ile tedavi edilen hastalarda alerjik reaksiyonların görülme sıklığı, düzenli insan insülini olan deri altı rejimleri kullananlara benzerdi.
Diğer insülin preparatlarında olduğu gibi, nadir fakat potansiyel olarak ciddi, insüline genelleştirilmiş alerji meydana gelebilir, bu da neden olabilir Tüm vücutta döküntü (kaşıntı dahil), nefes darlığı, hırıltılı solunum, kan basıncında azalma, hızlı nabız veya terlemek. Anafilaktik reaksiyonlar da dahil olmak üzere şiddetli genel alerji vakaları hayatı tehdit edici olabilir. Exubera'dan bu tür reaksiyonlar meydana gelirse, Exubera durdurulmalı ve alternatif tedaviler dikkate alınmalıdır.
Antikor Üretimi
Exubera dahil tüm insülin preparatları ile tedavi sırasında insülin antikorları gelişebilir. Karşılaştırıcının deri altı insülin olduğu Exubera'nın klinik çalışmalarında, insülin antikor düzeylerinde ( insülin bağlama aktivitesi), Exubera alan hastalar için subkutan insülin alan hastalardan anlamlı olarak daha yüksekti. bir tek. Exubera'nın klinik çalışmaları sırasında bu antikorların hiçbir klinik sonucu tespit edilmemiştir; bununla birlikte, antikor oluşumundaki bu artışın uzun dönemli klinik önemi bilinmemektedir.
Solunum
Pulmoner fonksiyon
İki yıla kadar süren klinik çalışmalarda, Exubera ile tedavi edilen hastalar solunum fonksiyonlarında daha büyük bir düşüş gösterdi, özellikle karşılaştırıcı ile işleme tabi tutulandan bir saniyedeki zorla ekspiratuar hacim (FEV1) ve karbon monoksit difüzyon kapasitesi (DLCO) Hastalar. Karşılaştırma grubunu tercih eden solunum fonksiyonundaki ortalama tedavi grubu farkı, Exubera ile tedavinin ilk birkaç haftası ve iki yıllık tedavi süresi boyunca değişmedi (Görmek TERS TEPKİLER: Pulmoner fonksiyon).
Kontrollü klinik çalışmalar sırasında, her iki hasta da her iki tedavi grubunda da solunum fonksiyonlarında belirgin düşüşler yaşamıştır. Son gözlemde başlangıç FEV1 değerinde â ‰ ¥% 20'lik bir düşüş Exubera ile tedavi edilen hastaların% 1.5'inde ve karşılaştırıcı ile tedavi edilen hastaların% 1.3'ünde bir düşüş meydana geldi. Temel DL'den bir düşüşCO son gözlemde ‰ ‰ ¥% 20'si Exubera ile tedavi edilen hastaların% 5.1'inde ve karşılaştırmalı tedavi edilen hastaların% 3.6'sında meydana gelmiştir.
Exubera'nın solunum fonksiyonu üzerindeki etkisi nedeniyle, tüm hastalarda Exubera ile tedaviye başlamadan önce spirometri (FEV1) değerlendirilmelidir. DL DeğerlendirmesiCO değerlendirilebilir. Başlangıç FEV'si olan hastalarda Exubera'nın etkinliği ve güvenliği1 veya DLCO
Solunum fonksiyonunun değerlendirilmesi (örn. Spirometri) tedavinin ilk 6 ayından sonra ve daha sonra yılda bir kez pulmoner semptomların yokluğunda bile önerilmektedir. Başlangıçtan FEV1'de â dec ¥ 20% düşüş gösteren hastalarda solunum fonksiyon testleri tekrarlanmalıdır. Başlangıç FEV1 değerindeki â ¥% 20'lik düşüş onaylanırsa, Exubera kesilmelidir. Pulmoner semptomların varlığı ve pulmoner fonksiyonda daha az düşüş olması, pulmoner fonksiyonun daha sık izlenmesini ve Exubera'nın kesilmesinin düşünülmesini gerektirebilir.
Altta yatan Akciğer Hastalığı
Exubera'nın astım veya KOAH gibi altta yatan akciğer hastalığı olan hastalarda kullanılması önerilmez, çünkü Exubera'nın bu popülasyondaki etkinliği ve güvenliği belirlenmemiştir.
bronkospazm
Exubera alan hastalarda bronkospazm nadiren bildirilmiştir. Böyle bir reaksiyon yaşayan hastalar Exubera'yı bırakmalı ve derhal tıbbi değerlendirme almalıdır. Exubera'nın yeniden uygulanması dikkatli bir risk değerlendirmesi gerektirir ve sadece uygun klinik imkanlarla yakın tıbbi izleme altında yapılmalıdır.
Intercurrent Solunum Hastalıkları
Eksubera, klinik çalışmalar sırasında interkervatif solunum hastalığı olan hastalara (örn. Bronşit, üst solunum yolu enfeksiyonları, rinit) uygulanmıştır. Bu rahatsızlıkları yaşayan hastalarda% 3-4 geçici olarak Eksubera tedavisine son vermiştir. Subkütan insülin ile tedavi edilen hastalara kıyasla, Exubera ile tedavi edilen hastalarda hipoglisemi veya kötüleşmiş glisemik kontrol riski gözlenmemiştir. Araya giren solunum yolu hastalıkları sırasında, kan şekeri konsantrasyonlarının yakından izlenmesi ve doz ayarlaması gerekebilir.
Hastalar İçin Bilgiler
Hastalara glikoz izleme; uygun Exubera inhalasyon tekniği; ve hipoglisemi ve hiperglisemi yönetimi. Hastalara, intercurrent koşulları (hastalık, stres veya duygusal) gibi özel durumların ele alınması konusunda talimat verilmelidir. rahatsızlıklar), yetersiz veya atlanmış bir insülin dozu, artmış bir insülin dozunun yanlışlıkla uygulanması, yetersiz gıda alımı veya yemekler atlandı.
Hastalar klinik çalışmalarda, Exubera ile tedavinin karşılaştırıcı tedavilere göre solunum fonksiyonundaki küçük, ilerleyici olmayan ortalama düşüşlerle ilişkili olduğu konusunda bilgilendirilmelidir. Exubera'nın solunum fonksiyonu üzerindeki etkisi nedeniyle, Exubera ile tedaviye başlamadan önce solunum fonksiyon testleri önerilir. Tedaviye başlandıktan sonra periyodik solunum fonksiyon testleri önerilir (bkz. ÖNLEMLER Solunum, Solunum Fonksiyonu).
Hastalar, akciğer hastalığı öyküsü varsa doktorlarını bilgilendirmelidir, çünkü Exubera kullanımı tavsiye edilmez. altta yatan akciğer hastalığı olan hastalar (örn. astım veya KOAH) ve zayıf kontrollü akciğeri olan hastalarda kontrendikedir hastalığı.
Diyabetli kadınlara, hamilelik veya hamilelik yapmayı düşünüyorlarsa doktorlarını bilgilendirmeleri tavsiye edilmelidir.
üst
İlaç etkileşimleri
Bazı maddeler glikoz metabolizmasını etkiler ve insülin dozu ayarlaması ve özellikle yakından izleme gerektirebilir.
Aşağıdakiler, hiperglisemiye neden olabilecek insülinin kan şekerini düşürücü etkisini azaltabilen maddelerin örnekleridir: kortikosteroidler, danazol, diazoksit, diüretikler, sempatomimetik ajanlar (örn., epinefrin, albuterol, terbutalin), glukagon, izoniazid, fenotiazin türevleri, somatropin, tiroid hormonları, östrojenler, progestojenler (örn. oral kontraseptiflerde), proteaz inhibitörleri ve atipik antipsikotik ilaçlar (örn. olanzapin ve klozapin).
Aşağıdakiler, insülinin kan şekerini düşürücü etkisini ve hipoglisemiye yatkınlığı artırabilecek maddelerin örnekleridir: oral antidiyabetik ürünler, ACE inhibitörleri, disopiramid, fibratlar, fluoksetin, MAO inhibitörleri, pentoksifilin, propoksifen, salisilatlar ve sülfonamid antibiyotikler.
Beta-blokerler, klonidin, lityum tuzları ve alkol, insülinin kan şekerini düşürücü etkisini artırabilir veya azaltabilir. Pentamidin, bazen hiperglisemi ile takip edilebilen hipoglisemiye neden olabilir.
Ek olarak, beta-blokerler, klonidin, guanetidin ve reserpin gibi sempatolitik tıbbi ürünlerin etkisi altında hipogliseminin belirti ve semptomları azaltılabilir veya olmayabilir.
Bronkodilatörler ve diğer solunan ürünler, solunan insan insülininin emilimini değiştirebilir (bkz. KLİNİK FARMAKOLOJİ, Özel Nüfuslar). Exubera uygulamasına göre bronkodilatör dozlarının tutarlı zamanlaması, kan şekeri konsantrasyonlarının yakından izlenmesi ve uygun şekilde doz titrasyonu önerilmektedir.
Karsinogenez, Mutajenez, Doğurganlık Bozukluğu
Hayvanlarda iki yıllık kanserojenlik çalışmaları yapılmamıştır. İnsülin, metabolik aktivasyonun varlığında ve yokluğunda Ames bakteriyel ters mutasyon testinde mutajenik değildi.
Sprague-Dawley sıçanlarında, insülin inhalasyon tozu ile 5.8 mg / kg / gün'e kadar dozlarda (klinikle karşılaştırıldığında) 6 aylık bir tekrar doz toksisite çalışması gerçekleştirilmiştir. 0.15 mg / kg / gün başlangıç dozu, sıçan yüksek dozu, bir mg / kg veya bir mg / m2 vücut yüzey alanı karşılaştırmasına dayanarak, klinik dozun 39 katı veya 8.3 katıdır). Cynomolgus maymunlarında, inhale insülin ile 0.64 mg / kg / gün'e kadar dozlarda 6 aylık bir tekrar doz toksisite çalışması gerçekleştirilmiştir. 0.15 mg / kg / gün klinik başlangıç dozu ile karşılaştırıldığında, maymun yüksek dozu, mg / kg veya bir mg / m2 vücut yüzey alanı karşılaştırmasına dayanarak, klinik dozun 4.3 katı veya 1.4 katı olmuştur. Bunlar hipoglisemiye dayanan maksimum tolere edilen dozlardır.
Kontrol hayvanlarıyla karşılaştırıldığında, her iki türün de akciğer fonksiyonu, solunum yolunun brüt veya mikroskopik morfolojisi veya bronşiyal lenf nodları üzerinde tedaviyle ilişkili olumsuz etkileri yoktu. Benzer şekilde, her iki türde de akciğerin alveolar veya bronşiolar bölgesinde hücre proliferasyon indeksleri üzerinde herhangi bir etkisi yoktu.
Rekombinant insan insülini endojen hormonla aynı olduğundan, hayvanlarda üreme / doğurganlık çalışmaları yapılmamıştır.
Gebelik
Teratojenik Etkiler
Gebelik Kategorisi C
Exubera ile hayvan üreme çalışmaları yapılmamıştır. Exubera'nın hamile bir kadına uygulandığında fetal hasara neden olup olamayacağı veya Exubera'nın üreme kapasitesini etkileyip etkileyemeyeceği de bilinmemektedir. Exubera hamile bir kadına ancak açıkça ihtiyaç duyulduğunda verilmelidir.
Emziren Anneler
İnsan insülini de dahil olmak üzere birçok ilaç anne sütüne geçer. Bu nedenle, Exubera emziren bir kadına uygulandığında dikkatli olunmalıdır. Emziren diyabetli hastalar, Exubera dozunda, yemek planında veya her ikisinde de ayarlamalar gerektirebilir.
Pediyatrik Kullanım
Exubera'nın pediatrik hastalarda uzun süreli güvenliği ve etkinliği belirlenmemiştir (bkz. KLİNİK FARMAKOLOJİ, Özel Nüfuslar).
Geriyatrik Kullanım
Kontrollü Faz 2/3 klinik çalışmalarında (n = 1975) Exubera 65 yaş ve 266 hastaya 75 yaş ve üstü 30 hastaya uygulanmıştır. Bu hastaların çoğunda tip 2 diyabet vardı. HbA'daki değişim1C ve hipoglisemi oranı yaşa göre değişmedi.
üst
Ters tepkiler
Exubera'nın tek başına veya deri altı insülin veya oral ajanlarla birlikte güvenliği maruz kalınan tip 1 veya tip 2 diyabetli yaklaşık 2500 yetişkin hastada değerlendirildi Exubera. Yaklaşık 2000 hasta 6 aydan daha uzun süre Exubera'ya ve 800'den fazla hasta 2 yıldan fazla maruz kalmıştır.
Solunum Dışı Advers Olaylar
Nedeni ne olursa olsun kontrollü Faz 2/3 klinik çalışmalarında 1977 Exubera ile tedavi edilen hastaların â ¥ 1% 'nde bildirilen solunum dışı advers olaylar aşağıdakileri içerir (ancak bunlarla sınırlı değildir):
Metabolik ve Beslenme: hipoglisemi (bkz. UYARILAR ve ÖNLEMLER)
Bir bütün olarak vücut: göğüs ağrısı
Sindirim: ağız kuruluğu
Özel duyular: orta kulak iltihabı (tip 1 pediatrik diyabet hastaları)
hipoglisemi
Hipoglisemi oranları ve insidansı, tip 1 ve tip 2 diyabetli hastalarda Exubera ve deri altı düzenli insan insülini arasında benzerdi. Tek oral ajan tedavisi ile yeterince kontrol altına alınmayan tip 2 hastalarda, Exubera, ikinci bir oral ilacın eklenmesinden daha yüksek bir hipoglisemi oranı ile ilişkiliydi ajan.
Göğüs ağrısı
Bir dizi farklı göğüs semptomu advers reaksiyon olarak bildirilmiştir ve spesifik olmayan göğüs ağrısı terimi altında gruplandırılmıştır. Bu olaylar Exubera ile tedavi edilen hastaların% 4.7'sinde ve karşılaştırma gruplarındaki hastaların% 3.2'sinde meydana gelmiştir. Bu olayların çoğunluğu (>% 90) hafif veya orta düzeyde olarak bildirilmiştir. Exubera'daki iki hasta ve karşılaştırma grubundaki bir hasta göğüs ağrısı nedeniyle tedaviyi bıraktı. Anjina pektoris veya miyokard enfarktüsü gibi koroner arter hastalığına bağlı tüm nedensel advers olayların insidansı Exubera'da karşılaştırılabilir (% 0.7 anjin pektoris; % 0.7 miyokard enfarktüsü) ve karşılaştırıcı (% 1.3 anjina pektoris; % 0.7 miyokard enfarktüsü) tedavi grupları.
Kuru ağız
Exubera ile tedavi edilen hastaların% 2.4'ünde ve karşılaştırma gruplarındaki hastaların% 0.8'inde ağız kuruluğu bildirilmiştir. Bildirilen kuru ağızların neredeyse tamamı (>% 98) hafif veya orta düzeydeydi. Hiçbir hasta ağız kuruluğu nedeniyle tedaviyi bırakmadı.
Pediatrik Diyabetiklerde Kulak Olayları
Exubera gruplarındaki pediatrik tip 1 diyabetliler, sadece subkutan insülin alan tedavi gruplarında pediatrik tip 1 diyabetlilerden daha sık kulak ile ilgili advers olaylar yaşadılar. Bu olaylar otitis media (Exubera 6.5%; SC% 3.4), kulak ağrısı (Exubera% 3.9; SC% 1.4) ve kulak bozukluğu (Exubera% 1.3; SC% 0).
Solunum Yan Etkileri
Tablo 6 rapor edilen her tedavi grubu için solunum advers olay insidansını göstermektedir nedensellik ne olursa olsun kontrollü Faz 2 ve 3 klinik çalışmalarda herhangi bir tedavi grubunun% 1'inde.
Tablo 6: Kontrollü Faz 2 ve 3 Klinik Çalışmalarda Herhangi Bir Tedavi Grubunun us 1 ¥% 1'inde Nedensellikten bağımsız Olarak Bildirilen Solunum Advers Olayları
| Olayı Bildiren Hastaların Yüzdesi | |||||
|---|---|---|---|---|---|
| Olumsuz Olay | Tip 1 Diyabet | 2 tip diyabet | |||
| Exubera N = 698 |
SC N = 705 |
Exubera N = 1279 |
SC N = 488 |
OAS N = 644 |
|
| SC = deri altı insülin karşılaştırıcı; OA = oral ajan karşılaştırıcılar | |||||
| Solunum yolu enfeksiyonu | 43.3 | 42.0 | 29.2 | 38.1 | 19.7 |
| Öksürük Arttı | 29.5 | 8.8 | 21.9 | 10.2 | 3.7 |
| Farenjit | 18.2 | 16.6 | 9.5 | 9.6 | 5.9 |
| Rinit | 14.5 | 10.9 | 8.8 | 10.5 | 3.0 |
| Sinüzit | 10.3 | 7.4 | 5.4 | 10.0 | 2.3 |
| Solunum Bozukluğu | 7.4 | 4.1 | 6.1 | 10.2 | 1.7 |
| solunum güçlüğü | 4.4 | 0.9 | 3.6 | 2.5 | 1.4 |
| Balgam Arttı | 3.9 | 1.3 | 2.8 | 1.0 | 0.5 |
| Bronşit | 3.2 | 4.1 | 5.4 | 3.9 | 4.0 |
| Astım | 1.3 | 1.3 | 2.0 | 2.3 | 0.5 |
| Epistaksis | 1.3 | 0.4 | 1.2 | 0.4 | 0.8 |
| Larenjit | 1.1 | 0.4 | 0.5 | 0.4 | 0.3 |
| Zatürre | 0.9 | 1.1 | 0.9 | 1.6 | 0.6 |
| Ses Değişikliği | 0.1 | 0.1 | 1.3 | 0.0 | 0.3 |
Öksürük
3 klinik çalışmada, öksürük anketini dolduran hastalar öksürüğün Exubera inhalasyonundan saniye ila dakikalar sonra, ağırlıklı olarak hafif şiddetliydi ve doğa. Bu öksürük görülme sıklığı, Exubera'nın sürekli kullanımı ile azalmıştır. Kontrollü klinik çalışmalarda, hastaların% 1.2'sinde öksürük nedeniyle Exubera tedavisi kesildi.
solunum güçlüğü
Dispne'nin neredeyse tamamı (>% 97) hafif veya orta derecede olarak bildirilmiştir. Exubera ile tedavi edilen az sayıda hasta (% 0.4), karşılaştırıcı ile tedavi edilen hastaların% 0.1'ine kıyasla dispne nedeniyle tedaviyi bıraktı.
Diğer Solunumsal Olumsuz Olaylar - Farenjit, Balgam Arttı ve Epistaksis
Bu olayların çoğu hafif veya orta düzeyde olarak bildirilmiştir. Exubera ile tedavi edilen az sayıda hasta farenjit (% 0.2) ve balgam nedeniyle (% 0.1) tedaviyi bıraktı; hiçbir hasta burun kanaması nedeniyle tedaviyi bırakmadı.
Pulmoner fonksiyon
Exubera'nın solunum sistemi üzerindeki etkisi kontrollü faz 2 ve 3 klinik çalışmalarda (1977 hastanın Exubera ile tedavi edildiği) 3800'den fazla hastada değerlendirilmiştir. İki yıla kadar randomize, açık etiketli klinik çalışmalarda, Exubera ile tedavi edilen hastalar pulmoner fonksiyonda, özellikle de birinde zorlanan ekspiratuar hacimde daha büyük bir düşüş gösterdi saniye (FEV1) ve karbon monoksit yayma kapasitesi (DLCO), karşılaştırmalı tedavi gören hastalara göre. FEV'deki ortalama tedavi grubu farklılıkları1 ve DLCO, Exubera ile tedavinin ilk birkaç haftasında kaydedildi ve iki yıllık tedavi süresi boyunca ilerleme kaydetmedi. Exubera ile iki yıllık tedaviyi takiben tip 2 diyabetli hastalarda tamamlanmış kontrollü klinik bir çalışmada, hastalar FEV'deki tedavi grubu farkının çözümlendiğini gösterdi1 tedavinin kesilmesinden altı hafta sonra. Tip 1 diyabetli hastalarda Exubera'nın solunum fonksiyonu üzerindeki etkisinin çözümü uzun süreli tedaviden sonra incelenmemiştir.
Şekil 3 ila 6, ortalama FEV değerini gösterir1 ve DLCO Tip 1 diyabetli 580 hastada ve tip 2 diyabetli 620 hastada devam eden iki randomize, açık etiketli, iki yıllık çalışmalardan taban çizgisine göre zamana göre değişim.
Figür 3: Tip 1 Diyabetli Hastalarda Başlangıç FEV1 (L) 'den değişim (Ortalama +/- Standart Sapma)

Şekil 4: Tip 2 Diyabetli Hastalarda Başlangıç FEV1 (L) 'den değişim (Ortalama +/- Standart Sapma)
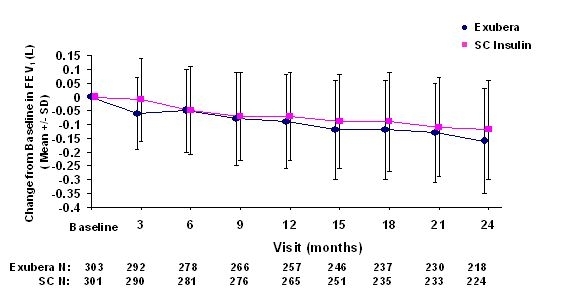
Tip 1 ve tip 2 diyabetli hastalarda 2 yıllık Exubera tedavisinin ardından fark bazal FEV1'den ortalama değişim için tedavi grupları arasında yaklaşık 40 mL idi. karşılaştırıcı.
Şekil 5: Tip 1 Diyabetli Hastalarda Temel DLco'dan (mL / dak / mmHg) değişim (Ortalama +/- Standart Sapma)
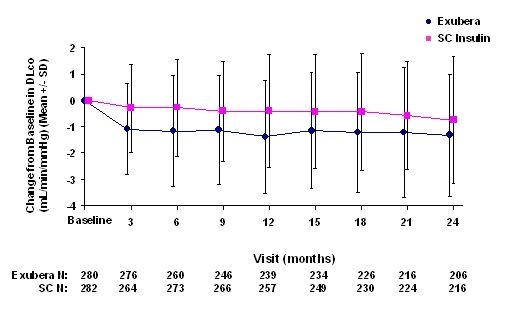
Şekil 6: Tip 2 Diyabetli Hastalarda Temel DLco'dan (mL / dak / mmHg) değişim (Ortalama +/- Standart Sapma)

2 yıllık Exubera tedavisinin ardından, temel DL'den ortalama değişim için tedavi grupları arasındaki farkCO karşılaştırıcıyı destekleyen yaklaşık 0.5 mL / dk / mmHg (tip 1 diyabet) ve Exubera'yı destekleyen yaklaşık 0.1 mL / dk / mmHg (tip 2 diyabet) idi.
İki yıllık klinik çalışmalar sırasında, her iki hasta da her iki tedavi grubunda da solunum fonksiyonlarında belirgin düşüşler yaşamıştır. Temel FEV'den düşüş1 son gözlemde â Ex ¥% 20'si Exubera ile tedavi edilen hastaların% 1.5'inde ve karşılaştırıcı ile tedavi edilen hastaların% 1.3'ünde meydana gelmiştir. Temel DL'den bir düşüşCO son gözlemde ‰ ‰ ¥% 20'si Exubera ile tedavi edilen hastaların% 5.1'inde ve karşılaştırmalı tedavi edilen hastaların% 3.6'sında meydana gelmiştir.
üst
Doz Aşımı
Hipoglisemi, gıda alımına, enerji tüketimine veya her ikisine birden fazla insülinin bir sonucu olarak ortaya çıkabilir.
Hafif ila orta şiddette hipoglisemi atakları genellikle oral glukoz ile tedavi edilebilir. İlaç dozajında, yemek düzenlerinde veya egzersizde ayarlamalar gerekebilir.
Koma, nöbet veya nörolojik bozukluğu olan şiddetli hipoglisemi atakları intramüsküler / subkutan glukagon veya konsantre intravenöz glikoz ile tedavi edilebilir. Belirgin klinik iyileşmeden sonra hipoglisemi tekrarlayabileceğinden sürekli karbonhidrat alımı ve gözlemi gerekebilir.
üst
Dozaj ve Uygulama
Eksubera, hızlı etkili insülin analogları gibi, deri altına enjekte edilen normal insan insülinine kıyasla daha hızlı bir glikoz düşürücü aktiviteye sahiptir. Exubera, deri altına enjekte edilen normal insan insülinine benzer ve hızlı etkili insülinden daha uzun bir glikoz düşürücü aktiviteye sahiptir. Exubera dozları yemeklerden hemen önce uygulanmalıdır (her yemekten en fazla 10 dakika önce).
Tip 1 diyabetli hastalarda, daha uzun etkili insülin içeren rejimlerde Exubera kullanılmalıdır. Tip 2 diyabetli hastalar için Exubera, monoterapi olarak veya oral ajanlar veya daha uzun etkili insülin ile kombinasyon halinde kullanılabilir.
Exubera'nın pulmoner fonksiyon üzerindeki etkisi nedeniyle, tüm hastaların Exubera ile tedaviye başlamadan önce solunum fonksiyonlarının değerlendirilmesi gerekir. Exubera ile tedavi edilen hastalarda solunum fonksiyonlarının periyodik olarak izlenmesi önerilir (bkz. ÖNLEMLER, Pulmoner fonksiyon).
Exubera, soluma yoluyla uygulama amaçlıdır ve sadece Exubera kullanılarak uygulanmalıdır.® İnhaler. Bakın Exubera İlaç Rehberi Exubera açıklaması için® Inhaler ve inhalerin nasıl kullanılacağı ile ilgili talimatlar için.
İlk Yemek Öncesi Eksubera Dozunun Hesaplanması
Exubera'nın başlangıç dozu, hastanın ihtiyaçlarına göre hekimin tavsiyesine göre kişiselleştirilmeli ve belirlenmelidir. Önerilen ilk yemek öncesi dozları, hastaların günde üç öğün yemek istedikleri klinik çalışmalara dayanmaktadır. Başlangıç yemek öncesi dozları aşağıdaki formül kullanılarak hesaplanabilir: [Vücut ağırlığı (kg) X 0,05 mg / kg = yemek öncesi doz (mg)] en yakın tam miligram sayısına yuvarlanmıştır (ör. 3.7 mg 3'e yuvarlanmıştır) mg).
Başlangıç, yemek öncesi Exubera dozları için, hastanın vücut ağırlığına göre yaklaşık yönergeler Tablo 7'de gösterilmiştir:
Tablo 7: Başlangıç, Yemek Öncesi Ekzoter Dozu için Yaklaşık Kılavuzlar (hastanın vücut ağırlığına göre)
| Hasta Ağırlığı (kg olarak) |
Hasta Ağırlığı (lb cinsinden) |
Yemek Başına Başlangıç Dozu | Doz Başına 1 mg Blister Sayısı | Doz Başına 3 mg Blister Sayısı |
|---|---|---|---|---|
| 30 ila 39,9 kg | 66-87 lb | Yemek başına 1 mg | 1 | - |
| 40 ila 59,9 kg | 88 - 132 lb | Yemek başına 2 mg | 2 | - |
| 60 ila 79.9 kg | 133 - 176 lb | Yemek başına 3 mg | - | 1 |
| 80 ila 99.9 kg | 177-220 lb | Yemek başına 4 mg | 1 | 1 |
| 100 ila 119.9 kg | 221-264 lb | Yemek başına 5 mg | 2 | 1 |
| 120 ila 139.9 kg | 265-308 lb | Yemek başına 6 mg | - | 2 |
1 mg'lik bir Exubera solunan insülin blisterı, 3 IU subkütan olarak enjekte edilmiş normal insan insülinine yaklaşık olarak eşdeğerdir. 3 mg'lık bir Exubera solunan insülin kabarcığı, deri altından enjekte edilen normal insan insülininin yaklaşık 8 IU'suna eşdeğerdir. Tablo 8, 1 mg'dan 6 mg'a kadar Exubera solunan insülin dozları için düzenli subkütan insan insülininin yaklaşık IU dozunu sağlar.
Tablo 8: 1 mg ila 6 mg arasında değişen Exubera Solunum İnsülin Dozları için Düzenli İnsan Subkutan İnsülinin Yaklaşık Eşdeğer IU Dozu
| Doz (mg) | İÜ'de Yaklaşık Düzenli İnsülin SC Dozu | Doz Başına 1 mg Exubera Blister Sayısı | Doz Başına 3 mg Exubera Blister Sayısı |
|---|---|---|---|
| 1 mg | 3 | 1 | - |
| 2 mg | 6 | 2 | - |
| 3 mg | 8 | - | 1 |
| 4 mg | 11 | 1 | 1 |
| 5 mg | 14 | 2 | 1 |
| 6 mg | 16 | - | 2 |
Hastalar, doz başına en az sayıda blister alınacak şekilde 1 mg ve 3 mg blisterleri birleştirmelidir (örn., 1 mg blister ve bir 3 mg blister olarak 4 mg doz uygulanmalıdır). Üç adet 1 mg'lık birim doz blisterinin ardışık olarak solunması, bir adet 3 mg'lık birim doz blisterin solunmasından önemli ölçüde daha fazla insülin maruziyeti ile sonuçlanır. Bu nedenle, 3 mg'lık bir doz için 1 mg'lık üç doz ikame edilmemelidir (bkz. KLİNİK FARMAKOLOJİ, Farmakokinetik). Bir hasta 3 mg kabarcık ve 3 mg kabarcık içeren bir doz rejiminde stabilize edildiğinde geçici olarak kullanılamaz hale gelirse, hasta geçici olarak 3 mg yerine iki adet 1 mg blister alabilir. blister. Kan şekeri yakından izlenmelidir.
Tüm insülinlerde olduğu gibi, Exubera başlangıç dozunu belirlerken dikkate alınması gereken ek faktörler şunları içerir, ancak hastanın mevcut glisemik kontrolü, insüline önceki yanıt, diyabet süresi ve diyet ve egzersiz ile sınırlı değildir alışkanlıkları.
Doz Titrasyonu ile İlgili Hususlar
Exubera tedavisine başladıktan sonra, diğer glikoz düşürücü ajanlarda olduğu gibi, doz ayarlaması, hastanın ihtiyacı (örn. kan şekeri konsantrasyonları, yemek büyüklüğü ve besin kompozisyonu, günün saati ve yakın zamanda veya beklenen) egzersiz yapmak). Her hasta kan şekeri izleme sonuçlarına göre optimal dozlarına göre titre edilmelidir.
Tüm insülinlere gelince, Exubera eyleminin zaman süreci farklı bireylerde veya aynı bireyde farklı zamanlarda değişebilir.
Exubera, interkervatif solunum hastalığı (örn. Bronşit, üst solunum yolu enfeksiyonu, rinit) sırasında kullanılabilir. Kan şekeri konsantrasyonlarının yakından izlenmesi ve bireysel olarak doz ayarlaması gerekebilir. İnhale edilen tıbbi ürünler (örn. Bronkodilatörler) Exubera verilmeden önce uygulanmalıdır.
üst
Nasıl tedarik edildi
Eksubera (insülin insanı [rDNA kökenli]) Soluma Toz 1 mg ve 3 mg birim doz kabarcıklarında mevcuttur. Kabarcıklar altı birim doz blisterden (PVC / Alüminyum) delikli kartlara dağıtılır. İki güç, renkli baskı ve dokunma ile ayırt edilebilen dokunsal işaretlerle ayırt edilir. 1 mg kabarcıklar ve ilgili delikli kartlar yeşil mürekkeple basılır ve kartlar yükseltilmiş bir çubukla işaretlenir. 3 mg'lık kabarcıklar ve ilgili delikli kartlar mavi mürekkeple basılır ve kartlar üç yükseltilmiş çubukla işaretlenir.
Beş blister kart şeffaf plastik (PET) termoform tepsiye yerleştirilmiştir. Her PET tepsisi ayrıca bir kurutucu içerir ve şeffaf bir plastik (PET) kapak ile kaplıdır. Beş blister kartın tepsisi (30 birim doz blister) bir kurutucu ile bir folyo laminat torbasında kapatılır.
Exubera (insülin insan [rDNA kökenli]) Soluma Toz kabarcıklar, bir Exubera® İnhaler ve değiştirme Exubera® Çıkış Üniteleri, Exubera ile tedaviyi başlatmak için gereklidir ve Exubera Kitinde sağlanır. Tamamen monte edilmiş bir Exubera® Inhaler, inhaler tabanı, bir oda ve bir Exubera'dan oluşur® Serbest Bırakma Birimi. Tamamen monte edilmiş bir Inhaler, bir Yedek Hazne ile paketlenmiştir ve Exubera Kitinde ve ayrı bir ünite olarak mevcuttur. Oda ayrıca bireysel bir bileşen olarak da mevcuttur.
Exubera® Ayırma Üniteleri, ayrı bir şekilde ısıyla kapatılmış termoform tepsiye paketlenir. Bir Exubera® Tamamen monte edilmiş her Inhaler'da Serbest Bırakma Ünitesi bulunur. Exubera Kitinde ve her Kombinasyon Paketinde iki ek Yayın Ünitesi daha bulunmaktadır. Exubera Tahliye Üniteleri ayrıca ayrı olarak da temin edilebilir.
Bu yapılandırmaların açıklaması için Tablo 9 ve 10'a bakın.
Tablo 9
| Eksubera (insülin insanı [rDNA kökenli]) Soluma Tozu aşağıdaki gibi mevcuttur: | ||
|---|---|---|
| Açıklama | içindekiler | NDC |
| Exubera KİTİ | 1 Exubera İnhaler 1 Yedek Hazne 1 mg 180 180 kabarcık 3 mg 90 90 kabarcık 2 Exubera® Yayın Birimleri |
0069-0050-85 |
| Exubera Kombinasyon Paketi 12 | 1 mg 90 90 kabarcık 3 mg 90 90 kabarcık 2 Exubera® Yayın Birimleri |
0069-0050-19 |
| Exubera Kombinasyon Paketi 15 | 1 mg 180 180 kabarcık 3 mg 90 90 kabarcık 2 Exubera® Yayın Birimleri |
0069-0050-53 |
| Exubera 1 mg Hasta Paketi | 90 × 1 mg 2 Exubera® Yayın Birimleri |
0069-0707-37 |
| Exubera 3 mg Hasta Paketi | 90 × 3 mg 2 Exubera® Yayın Birimleri |
0069-0724-37 |
Tablo 10
| Exubera® İnhaler ve Bileşenler aşağıdaki gibi mevcuttur: | ||
|---|---|---|
| Açıklama | içindekiler | NDC |
| Exubera® İnhaler ve Oda | 1 Exubera® soluk aldırma cihazı 1 Yedek Hazne |
0069-0054-19 |
| Exubera® Yayın Birimleri | 2 Exubera® Yayın Birimleri | 0069-0097-41 |
| Exubera® Bölme | 1 Yedek Hazne | 0069-0061-19 |
Blister Depolama
Kullanımda değil (Açılmamış): Kontrollü oda sıcaklığında, 25 ° C (77 ° F); 15-30 ° C'ye (59-86 ° F) izin verilen gezilere [bkz. USP Kontrollü Oda Sıcaklığı]. Dondurmayın. Buzdolabında saklamayın.
Kullanımda: Folyo sargısı açıldıktan sonra, birim doz blisterleri nemden korunmalı, 25 ° C'de (77 ° F) saklanmalıdır; 15-30 ° C'ye (59-86 ° F) izin verilen gezilere [bkz. USP Kontrollü Oda Sıcaklığı]. Dondurmayın. Buzdolabında saklamayın. Birim doz blisterleri, folyo sargısının açılmasından sonraki 3 ay içinde kullanılmalıdır. Nemden korumak için kabarcıkları üst sargıya geri koyun. Nemli ortamlardan kaçınmak için ek dikkat gösterilmelidir, örn. duş sonra buharlı banyo.
Donmuşsa blisteri atın.
İnhaler Deposu
Kontrollü oda sıcaklığında, 25 ° C (77 ° F); 15-30 ° C'ye (59-86 ° F) izin verilen gezilere [bkz. USP Kontrollü Oda Sıcaklığı]. Dondurmayın. Buzdolabında saklamayın.
Exubera® İnhaler, ilk kullanım tarihinden itibaren 1 yıla kadar kullanılabilir.
Exubera'nın Değiştirilmesi® Yayın Birimi
Exubera® Exubera'daki Yayın Birimi® İnhaler 2 haftada bir değiştirilmelidir.
Çocukların erişemeyeceği yerlerde saklayın
Yalnızca Rx

LAB-0.331-12,0
son değişiklik 04/2008
Exubera, insülin insanı [rDNA kökenli] Hasta bilgisi (Sade ingilizce)
Diyabetin Belirtileri, Belirtileri, Nedenleri, Tedavileri Hakkında Detaylı Bilgi
Bu monograftaki bilgilerin olası tüm kullanımları, talimatları, önlemleri, ilaç etkileşimlerini veya yan etkileri kapsaması amaçlanmamıştır. Bu bilgiler genelleştirilmiştir ve özel tıbbi tavsiye olarak tasarlanmamıştır. Aldığınız ilaçlar hakkında sorularınız varsa veya daha fazla bilgi istiyorsanız, doktorunuza, eczacınıza veya hemşirenize danışın.
geri dön: Diyabet için tüm İlaçlara göz atın



