Diyabet Tedavisinde Glukofaj
Marka Adı: Glucophage
Jenerik Adı: metformin hidroklorür
Dozaj Formu: uzatılmış salımlı tabletler
İçindekiler:
Açıklama
Klinik Farmakoloji
Göstergeler ve kullanımları
Kontrendikasyonlar
Uyarılar
Önlemler
İlaç etkileşimleri
Ters tepkiler
aşırı doz
Dozaj
Sağlanan
Glükofaj, metformin hidroklorür, hasta bilgisi (Sade ingilizce)
Açıklama
Glucophage® (metformin hidroklorür) Tabletler ve Glucophage® XR (metformin hidroklorür) Genişletilmiş Salım Tabletleri, tip 2 diyabet tedavisinde kullanılan oral antihiperglisemik ilaçlardır. Metformin hidroklorür (N, N-dimetilimidodikarbonimidik diamid hidroklorür), başka herhangi bir oral antihiperglisemik ajan sınıfı ile kimyasal veya farmakolojik olarak ilişkili değildir. Yapısal formül aşağıdaki gibidir:
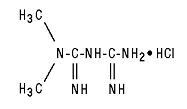
Metformin hidroklorür, C4H11N5-HCl moleküler formülü ve 165.63 molekül ağırlığı ile beyaz ila kirli beyaz bir kristal bileşiktir. Metformin hidroklorür suda serbestçe çözünür ve pratik olarak aseton, eter ve kloroformda çözünmez. Metforminin pKa değeri 12.4'tür. % 1 sulu metformin hidroklorür çözeltisinin pH'ı 6.68'dir.
Glukofaj tabletleri 500 mg, 850 mg veya 1000 mg metformin hidroklorür içerir. Her tablet inaktif bileşenler olan povidon ve magnezyum stearatı içerir. Ek olarak, 500 mg ve 850 mg tabletler için kaplama hipromelloz içerir ve 1000 mg tablet için kaplama hipromelloz ve polietilen glikol içerir.
Glukofaj XR, aktif bileşen olarak 500 mg veya 750 mg metformin hidroklorür içerir.
Glukofaj XR 500 mg tabletler, inaktif bileşenler sodyum karboksimetil selüloz, hipromelloz, mikrokristalin selüloz ve magnezyum stearat içerir.
Glukofaj XR 750 mg tabletler, inaktif bileşenler sodyum karboksimetil selüloz, hipromelloz ve magnezyum stearat içerir.
Sistem Bileşenleri ve Performance-Glucophage XR, çift hidrofilik bir polimer matris sistemi içerir. Metformin hidroklorür, daha sonra ikinci bir polimerin bir "harici" fazına ayrık partiküller halinde dahil edilen bir "iç" faz oluşturmak için bir ilaç salım kontrol polimeri ile birleştirilir. Uygulamadan sonra, gastrointestinal (GI) yoldan gelen sıvı tablete girerek polimerlerin hidratlanmasına ve şişmesine neden olur. İlaç, esasen pH'dan bağımsız olan jel matrisi boyunca bir difüzyon işlemi ile dozaj formundan yavaşça salınır. Hidratlanmış polimer sistemi sert değildir ve GI yolundaki normal peristalsis tarafından parçalanması beklenir. Tabletin biyolojik olarak eylemsiz bileşenleri, GI geçişi sırasında zaman zaman bozulmadan kalabilir ve dışkıda yumuşak, hidratlanmış bir kütle olarak elimine edilir.
üst
Klinik Farmakoloji
Hareket mekanizması
Metformin, tip 2 diyabetli hastalarda glikoz toleransını artıran, hem bazal hem de postprandiyal plazma glikozunu düşüren bir antihiperglisemik ajandır. Farmakolojik etki mekanizmaları, diğer oral antihiperglisemik ajan sınıflarından farklıdır. Metformin hepatik glikoz üretimini azaltır, glikozun bağırsak emilimini azaltır ve periferik glikoz alımını ve kullanımını artırarak insülin duyarlılığını artırır. Sülfonilürelerin aksine, metformin ne tip 2 diyabetli hastalarda ne de normal kişilerde hipoglisemi üretmez (özel durumlar hariç, bkz. ÖNLEMLER) ve hiperinsülinemiye neden olmaz. Metformin tedavisi ile açlık insülin seviyeleri değişirken insülin sekresyonu değişmeden kalır ve gün boyu plazma insülin cevabı gerçekten azalabilir.
Farmakokinetik
Soğurma ve Biyoyararlanım
Açlık koşulları altında verilen bir Glucophage 500 mg tabletin mutlak biyoyararlanımı yaklaşık% 50 ila% 60'tır. Tek oral Glucophage 500 ila 1500 mg ve 850 ila 2550 mg dozlarını kullanan çalışmalar, artan dozlarda doz orantılılığı; eliminasyon. Gıda, yaklaşık% 40 daha düşük ortalama pik plazma ile gösterildiği gibi metformin emiliminin derecesini azaltır ve biraz geciktirir konsantrasyon (Cmax), plazma konsantrasyonu altında zaman eğrisine (AUC) karşı% 25 daha düşük bir alan ve zirveye 35 dakikalık bir süre uzatılması Tek bir 850 mg metforminin gıda ile aynı tablet kuvvetine kıyasla uygulanmasını takiben plazma konsantrasyonu (Tmax) oruç tutma. Bu düşüşlerin klinik önemi bilinmemektedir.
Tek bir oral Glukofaj XR dozunu takiben, Cmax medyan değeri 7 saat ve 4 ila 8 saat aralığında elde edilir. Pik plazma seviyeleri, aynı Glükofaj dozuna kıyasla yaklaşık% 20 daha düşüktür, ancak emilim derecesi (AUC ile ölçüldüğü gibi) Glükofaj'a benzer.
Kararlı durumda, AUC ve Cmax, Glucophage XR için günde bir kez uygulanan 500 ila 2000 mg aralığında dozdan daha azdır. Pik plazma seviyeleri, günde bir kez 500, 1000, 1500 ve 2000 mg dozlar için yaklaşık 0.6, 1.1, 1.4 ve 1.8 ug / mL'dir. Glucophage XR'den günde bir kez 2000 mg'lik bir dozda metformin emiliminin (AUC ile ölçüldüğü gibi), günde iki kez 1000 mg Glukofaj tabletleri olarak verilen aynı toplam günlük doza benzer. Glukofaj XR'nin tekrar tekrar uygulanmasından sonra metformin plazmada birikmedi.
Glucophage XR'den metforminin Cmax ve AUC'sinde konu içi değişkenlik, Glucophage ile karşılaştırılabilir.
Glucophage XR tabletinden metformin emilimi (AUC ile ölçüldüğü gibi) Gıda ile birlikte verildiğinde yaklaşık% 50 oranında artmış, gıdaların Cmax ve Tmax üzerinde hiçbir etkisi olmamıştır. metformin. Hem yüksek hem de az yağlı yemekler, Glucophage XR'nin farmakokinetiği üzerinde aynı etkiye sahipti.
dağıtım
850 mg Glikofajın tek oral dozlarını takiben metforminin görünür dağılım hacmi (V / F) ortalama 654 ± 358 L idi. Metformin,% 90'dan fazla proteine bağlı olan sülfonilürelerin aksine, plazma proteinlerine ihmal edilebilir bir şekilde bağlanır. Metformin, büyük olasılıkla zamanın bir fonksiyonu olarak eritrositlere ayrılır. Her zamanki klinik dozlarda ve Glükofajın dozlama programlarında, metforminin kararlı durum plazma konsantrasyonlarına 24 ila 48 saat içinde ulaşılır ve genellikle
Metabolizma ve Eliminasyon
Normal deneklerdeki intravenöz tek doz çalışmaları metforminin değişmeden atıldığını göstermektedir. idrar ve hepatik metabolizmaya girmez (insanlarda metabolit tanımlanmamıştır) veya safra boşaltım. Renal klerens (bkz. tablo 1), kreatinin klerensinden yaklaşık 3.5 kat daha büyüktür, bu da tübüler sekresyonun metformin eliminasyonunun ana yolu olduğunu gösterir. Oral uygulamayı takiben, emilen ilacın yaklaşık% 90'ı ilk 24 saat içinde renal yoldan elimine edilir ve plazma eliminasyon yarılanma ömrü yaklaşık 6.2 saattir. Kanda, eliminasyon yarılanma ömrü yaklaşık 17.6 saattir, bu da eritrosit kütlesinin bir dağıtım kompartmanı olabileceğini düşündürmektedir.
Özel Nüfuslar
Tip 2 Diyabetli hastalar
Normal böbrek fonksiyonunun varlığında, tip 2 diyabetli hastalar ile normal kişiler arasında tek veya çok dozlu metforminin farmakokinetiği arasında fark yoktur (bkz. tablo 1) veya her iki grupta da normal klinik dozlarda metformin birikimi yoktur.
Tip 2 diyabetli hastalarda Glukofaj XR'nin farmakokinetiği, sağlıklı normal yetişkinlerde olanlarla karşılaştırılabilir.
Böbrek yetmezliği
Böbrek fonksiyonu azalmış hastalarda (ölçülen kreatinin klerensine bağlı olarak), plazma ve kan yarılanma ömrü metformin uzar ve kreatinin klerensindeki azalmaya orantılı olarak renal klerens azalır (bkz. tablo 1; ayrıca bak UYARILAR).
Karaciğer Yetmezliği
Karaciğer yetmezliği olan hastalarda hiçbir metformin farmakokinetik çalışması yapılmamıştır.
geriatri
Sağlıklı yaşlı kişilerde kontrollü glukofaj farmakokinetik çalışmalarından elde edilen sınırlı veriler toplam plazmanın sağlıklı gençlere kıyasla metformin klerensi azalır, yarılanma ömrü uzar ve Cmax artar konular. Bu verilerden, yaşlanma ile metformin farmakokinetiğindeki değişikliğin öncelikle böbrek fonksiyonundaki bir değişiklikten kaynaklandığı görülmektedir (bkz. tablo 1). Glukofaj (metformin hidroklorür) Tabletler ve Glucophage XR (metformin hidroklorür) Genişletilmiş Salım Tabletleri tedavisi Kreatinin klerensi ölçümü böbrek fonksiyonunun azalmadığını göstermediği sürece 80 yaşın altındaki hastalarda başlatılmalıdır (görmek UYARILAR ve KULLANIM ŞEKLİ VE DOZU).
Tablo 1: Tekli veya Çoklu Oral Glukofaj Dozu Takıldıktan Sonra Ortalama (± S.D.) Metformin Farmakokinetik Parametreleri Seçin
| Konu Grupları: Glukofaj dozubir (konu sayısı) |
Cmaksimumb (ug / mL) |
Tmaksimumc (Saat) |
Böbrek Temizliği (Ml / dakika) |
|---|---|---|---|
| bir Çoklu doz çalışmalarının ilk 18 dozu haricinde açlık verilen tüm dozlar | |||
| b En yüksek plazma konsantrasyonu | |||
| c En yüksek plazma konsantrasyonuna kadar geçen süre | |||
| d Beş çalışmanın birleşik sonuçları (ortalama araçlar): ortalama yaş 32 yıl (aralık 23-59 yıl) | |||
| e Açlık verildiğinde, doz 19'dan sonra yapılan kinetik çalışma | |||
| f Yaşlılar, ortalama yaş 71 yıl (65-81 yaş arası) | |||
| g CLcr = 1,73 m vücut yüzey alanına normalize edilmiş kreatinin klirensi2 | |||
| Sağlıklı, diyabetik olmayan yetişkinler: | |||
| 500 mg tek doz (24) | 1.03 ( ±0.33) | 2.75 ( ±0.81) | 600 ( ±132) |
| 850 mg tek doz (74)d | 1.60 ( ±0.38) | 2.64 ( ±0.82) | 552 ( ±139) |
| 19 doz için günde üç kez 850 mge (9) | 2.01 ( ±0.42) | 1.79 ( ±0.94) | 642 ( ±173) |
| Tip 2 diyabetli yetişkinler: | |||
| 850 mg tek doz (23) | 1.48 ( ±0.5) | 3.32 ( ±1.08) | 491 ( ±138) |
| 19 doz için günde üç kez 850 mge (9) | 1.90 ( ±0.62) | 2.01 ( ±1.22) | 550 ( ±160) |
| yaşlıf, sağlıklı diyabetik olmayan yetişkinler: | |||
| 850 mg tek doz (12) | 2.45 ( ±0.70) | 2.71 ( ±1.05) | 412 ( ±98) |
| Böbrek yetmezliği olan yetişkinler: | |||
| 850 mg tek doz | |||
| Hafif (CLcrg 61-90 mL / dakika) (5) | 1.86 ( ±0.52) | 3.20 ( ±0.45) | 384 ( ±122) |
| Orta (CLcr 31-60 mL / dakika) (4) | 4.12 ( ±1.83) | 3.75 ( ±0.50) | 108 ( ±57) |
| Şiddetli (CLcr 10-30 mL / dakika) (6) | 3.93 ( ±0.92) | 4.01 ( ±1.10) | 130 ( ±90 |
pediatri
Tek bir oral Glukofaj 500 mg tabletin gıda ile uygulanmasından sonra, geometrik ortalama metformin Cmax ve AUC arasında% 5'ten az fark vardı pediatrik tip 2 diyabetik hastalar (12-16 yaş) ve cinsiyet ve kilo uyumlu sağlıklı yetişkinler (20-45 yaş), hepsi normal renal fonksiyon
Cinsiyet
Metformin farmakokinetik parametreleri, cinsiyete göre analiz edildiğinde normal deneklerle tip 2 diyabetli hastalar arasında anlamlı farklılık göstermemiştir (erkekler = 19, kadınlar = 16). Benzer şekilde, tip 2 diyabetli hastalarda yapılan kontrollü klinik çalışmalarda, Glukofajın antihiperglisemik etkisi erkeklerde ve kadınlarda benzerdi.
Yarış
Yarışa göre metformin farmakokinetik parametrelerle ilgili herhangi bir çalışma yapılmamıştır. Tip 2 diyabetli hastalarda Glukofajın kontrollü klinik çalışmalarında, antihiperglisemik etki beyazlar (n = 249), siyahlar (n = 51) ve Hispaniklerde (n = 24) benzerdi.
Klinik çalışmalar
Glucophage
Hiperglisemi ile yeterince kontrol edilmemiş tip 2 diyabetli obez hastaları içeren çift kör, plasebo kontrollü, çok merkezli bir ABD klinik çalışmasında tek başına diyet yönetimi (yaklaşık 240 mg / dL bazal açlık plazma glikozu [FPG]), 29 hafta boyunca Glükofaj (2550 mg / güne kadar) ile tedavi önemli ölçüde sonuçlandı plasebo grubuna kıyasla açlık ve postprandiyal plazma glukozunda (PPG) ve hemoglobin A1c'de (HbA1c) sırasıyla 59 mg / dL, 83 mg / dL ve% 1.8 ortalama net azalma (bkz. Tablo 2).
Tablo 2: Açlık Plazma Glikozu, HbA'da Glukofaj ve Plasebo ile Ortalama Başlangıçtaki Değişikliklerin Özeti1cve Son Ziyarette Vücut Ağırlığı (29 haftalık çalışma)
| Glucophage (N = 141) |
plasebo (N = 145) |
p-Değeri | |
|---|---|---|---|
| * Başlangıçta diyet tedavisi alan tüm hastalar | ** İstatistiksel olarak anlamlı değil | ||
| FPG (mg / dL) Temel FİNAL ZİYARETTE Değişiklik |
241.5 -53.0 |
237.7 6.3 |
NS ** 0.001 |
| Hemoglobin A1c (%) Temel FİNAL ZİYARETTE Değişiklik |
8.4 -1.4 |
8.2 0.4 |
NS ** 0.001 |
| Vücut Ağırlığı (lbs) Temel FİNAL ZİYARETTE Değişiklik |
201.0 -1.4 |
206.0 -2.4 |
NS ** NS ** |
Glukofaj ve gliburitin 29 haftalık, çift kör, plasebo kontrollü bir çalışması, tip 2 olan obez hastalarda tek başına ve kombinasyon halinde yapıldı. maksimum gliburid dozlarında (yaklaşık 250 mg / dL bazal FPG) iken yeterli glisemik kontrol sağlayamayan diyabet (Tabloya bakınız) 3). Kombinasyon koluna randomize edilen hastalar 500 mg Glukofaj ve 20 mg gliburid ile tedaviye başladı. Çalışmanın ilk 4 haftasının her haftasının sonunda, bu hastalar, hedef açlık plazma glikozuna ulaşamamışsa, Glükofaj dozajlarını 500 mg arttırdılar. 4. haftadan sonra, bu tür doz ayarlamaları aylık olarak yapılmıştır, ancak hiçbir hastanın 2500 mg Glukofaj'ı aşmasına izin verilmemiştir. Sadece Glükofaj kolundaki hastalar (metformin artı plasebo) aynı titrasyon programını izledi. Deneyin sonunda, kombinasyon grubundaki hastaların yaklaşık% 70'i Glucophage 2000 mg / gliburid 20 mg veya Glucophage 2500 mg / gliburide 20 mg kullanıyordu. Gliburide devam etmek için randomize edilen hastalar, sırasıyla 14 mg / dL, 3 mg / dL ve% 0.2'lik ortalama FPG, PPG ve HbA1c artışlarıyla glisemik kontrolde kötüleşme yaşadı. Buna karşılık, Glükofaj'a randomize edilenler (2500 mg / güne kadar), FPG, PPG ve HbA1c'de sırasıyla 1 mg / dL, 6 mg / dL ve% 0.4'lük ortalama düşüşlerle hafif bir iyileşme yaşadı. Glukofaj ve gliburit kombinasyonu, FPG, PPG ve HbA1c seviyelerini sırasıyla 63 mg / dL, 65 mg / dL ve% 1.7 oranında azaltmada etkiliydi. Tek başına gliburit tedavisi sonuçları ile karşılaştırıldığında, kombinasyon tedavisi ile net farklar sırasıyla -77 mg / dL, -68 mg / dL ve% -1.9 idi (bakınız Tablo 3).
Tablo 3: Kombine Glukofaj / Gliburid (Tarak) ve Glyburide (Glyb) veya Glukofaj (GLU) Monoterapisi: Oruç Plazma Glikozunda HbA'da Ortalama * Değişikliklerin Özeti1cve Son Ziyarette Vücut Ağırlığı (29 haftalık çalışma)
| p-değerleri | ||||||
|---|---|---|---|---|---|---|
| Tarak (N = 213) |
gLYB (N = 209) |
GLU (N = 210), |
Glyb vs Tarak |
GLU vs Tarak |
GLU vs gLYB |
|
| * Başlangıçta 20 mg / gün gliburid kullanan tüm hastalar | ** İstatistiksel olarak anlamlı değil | |||||
| Açlık Plazma Glikozu (mg / dL) | ||||||
| Temel FİNAL ZİYARETTE Değişiklik |
250.5 -63.5 |
247.5 13.7 |
253.9 -0.9 |
NS ** 0.001 |
NS ** 0.001 |
NS ** 0.025 |
| Hemoglobin A1c (%) | ||||||
| Temel FİNAL ZİYARETTE Değişiklik |
8.8 -1.7 |
8.5 0.2 |
8.9 -0.4 |
NS ** 0.001 |
NS ** 0.001 |
0.007 0.001 |
| Vücut Ağırlığı (lbs) | ||||||
| Temel FİNAL ZİYARETTE Değişiklik |
202.2 0.9 |
203.0 -0.7 |
204.0 -8.4 |
NS ** 0.011 |
NS ** 0.001 |
NS ** 0.001 |
Kurumdan sonra açlık kan şekeri konsantrasyonundaki düşüşün büyüklüğü Glukofaj (metformin hidroklorür) Tablet tedavisi, açlık seviyesiyle orantılıydı hiperglisemi. Daha yüksek açlık glikoz konsantrasyonları olan tip 2 diyabetli hastalarda plazma glikozu ve glikosile hemoglobin daha büyük düşüşler yaşadı.
Klinik çalışmalarda, glukofaj, tek başına veya bir sülfonilüre ile kombinasyon halinde, ortalama açlık serumunu düşürdü trigliseritler, toplam kolesterol ve LDL kolesterol seviyeleri ve diğer lipit seviyeleri üzerinde olumsuz etkileri yoktu (bkz. Tablo 4).
Tablo 4: Son Ziyarette Major Serum Lipid Değişkenlerinin Başlangıç Noktasından Ortalama Yüzde Değişiminin Özeti (29 haftalık çalışmalar)
| Glukofaj ve Plasebo | Kombine Glukofaj / Glyburide vs Monoterapi |
||||
|---|---|---|---|---|---|
| Glucophage (N = 141) |
plasebo (N = 145) |
Glucophage (N = 210), |
Glucophage / Gliburid'in (N = 213) |
Gliburid'in (N = 209) |
|
| Toplam Kolesterol (mg / dL) | |||||
| Temel FİNAL ZİYARETTE Ortalama% Değişim |
211.0 -5% |
212.3 1% |
213.1 -2% |
215.6 -4% |
219.6 1% |
| Toplam Trigliseritler (mg / dL) | |||||
| Temel FİNAL ZİYARETTE Ortalama% Değişim |
236.1 -16% |
203.5 1% |
242.5 -3% |
215.0 -8% |
266.1 4% |
| LDL-Kolesterol (mg / dL) | |||||
| Temel FİNAL ZİYARETTE Ortalama% Değişim |
135.4 -8% |
138.5 1% |
134.3 -4% |
136.0 -6% |
137.5 3% |
| HDL-Kolesterol (mg / dL) | |||||
| Temel FİNAL ZİYARETTE Ortalama% Değişim |
39.0 2% |
40.5 -1% |
37.2 5% |
39.0 3% |
37.0 1% |
Sülfonilürelerin aksine, Glükofajlı bireylerin vücut ağırlığı sabit kalma veya hatta bir miktar düşme eğilimindedir (bkz. Tablolar 2 ve 3).
Glucophage artı insüline karşı insülin artı plaseboya ilişkin 24 haftalık, çift kör, plasebo kontrollü bir çalışma sadece insülin üzerinde yeterli glisemik kontrol sağlayamayan tip 2 diyabetli hastalarda yapılır (bkz. Tablo 5). Glukofaj artı insülin almak için randomize edilen hastalar, insülin artı plasebo ile elde edilen HbA1c'de% 1.56'lık bir azalmaya kıyasla, HbA1c'de% 2.10'luk bir azalma elde etti. Glisemik kontrolde iyileşme, son çalışma ziyaretinde sırasıyla% 16 daha az insülin, 93.0 U / gün'e karşı 110.6 U / gün, Glukofaj artı insüline karşı insülin artı plasebo ile sağlandı, p = 0.04.
Tablo 5: Kombine Glukofaj / İnsülin ve Plasebo / İnsülin HbA'da Başlangıçtaki Ortalama Değişikliklerin Özeti1c ve Günlük İnsülin Dozu
| Glucophage / ensülin (N = 26), |
plasebo / ensülin (N = 28) |
tedavi fark Ortalama ± SE |
|
|---|---|---|---|
|
bir Değişken olarak taban çizgisi ile kovaryans analizi kullanılarak istatistiksel olarak anlamlı (p = 0.04) Varyans analizi kullanıldığında anlamlı değil (değerler tabloda gösterilmiştir) | |||
| b İnsülin için istatistiksel olarak anlamlı (p = 0,04) | |||
| Hemoglobin A1c (%) | |||
| Temel FİNAL ZİYARETTE Değişiklik |
8.95 -2.10 |
9.32 -1.56 |
-0.54 ± 0.43bir |
| İnsülin Dozu (U / gün) | |||
| Temel FİNAL ZİYARETTE Değişiklik |
93.12 -0.15 |
94.64 15.93 |
-16.08 ± 7.77b |
16 haftalık randomize tedavi uygulanan ikinci bir çift kör, plasebo kontrollü çalışma (n = 51), tip 2 diyabetli hastalarda 8 hafta boyunca insülin üzerinde kontrol olduğunu gösterdi. ortalama HbA1c% 7.46 ± 0.97 ile Glucophage ilavesi benzer glisemik kontrolü sürdürdü (Gbochage insülin ve plasebo plus için HbA1c 7.15 ± 0.61'e karşı 6.97 ± 0.62 insülin) bazal değere göre% 19 daha az insülin (Glukofaj artı insülin ve plasebo artı insülin için 0.43 ± 25.20 birim artışa karşı 23.68 ± 30.22 azalma, p <0.01). Ek olarak, bu çalışma Glukofaj artı insülin kombinasyonunun azalmaya neden olduğunu göstermiştir. vücut ağırlığında 3.11 ± 4.30 lbs, plasebo artı insülin için 1.30 ± 6.08 lbs'lik bir artışa kıyasla, p = 0.01.
Glukofaj XR
Glucophage XR'nin akşam yemeği ile günde bir kez alınan 24 haftalık, çift kör, plasebo kontrollü bir çalışma, diyet ve egzersizle glisemik kontrol sağlayamayan tip 2 diyabetli hastalar (HbA1c% 7.0 -% 10.0, FPG 126-270 mg / dL). Çalışmaya giren hastaların ortalama başlangıç durumu HbA1c% 8.0 ve ortalama başlangıç FPG'si 176 mg / dL idi. 12 haftalık tedaviden sonra ortalama HbA1c başlangıç değerinden% 0.1 artmış ve ortalama FPG başlangıç değerinden plasebo grubunda 2 mg / dL azalmış, Glucophage XR 1000 mg ile tedavi edilen hastalarda ortalama HbA1c değerinde% 0.6 azalma ve ortalama FPG'de 23 mg / dL azalma ile karşılaştırıldığında günlük. Daha sonra, eğer HbA1c 7.0% 7.0 fakat
Glucophage XR'nin akşam yemeği ile günde bir kez veya yemeklerle günde iki kez alınan 16 haftalık, çift kör, plasebo kontrollü, doz cevap çalışması, diyet ve egzersizle glisemik kontrole erişemeyen tip 2 diyabetli hastalara uygulandı (HbA1c% 7.0-11.0%, FPG 126-280 mg / dL). Glisemik kontrol ve vücut ağırlığındaki değişiklikler Tablo 6'da gösterilmiştir.
Tablo 6: HbA'da Taban Çizgisinden * Ortalama Değişikliklerin Özeti1cZiyarette Oruç, Açlık Plazma Glikozu ve Vücut Ağırlığı (16 haftalık çalışma)
| Glukofaj XR | plasebo | |||||
|---|---|---|---|---|---|---|
| 500 mg bir Zamanlar Günlük |
1000 mg bir Zamanlar Günlük |
1500 mg bir Zamanlar Günlük |
2000 mg bir Zamanlar Günlük |
1000 mg İki defa Günlük |
||
| * Başlangıçta diyet tedavisi alan tüm hastalar | ||||||
| bir Tüm karşılaştırmalar - Placebo | ||||||
| ** İstatistiksel olarak anlamlı değil | ||||||
| Hemoglobin A1c (%) | (N = 115), | (N = 115), | (N = 111) | (N = 125) | (N = 112), | (N = 111) |
| Temel | 8.2 | 8.4 | 8.3 | 8.4 | 8.4 | 8.4 |
| FİNAL ZİYARETTE Değişiklik | -0.4 | -0.6 | -0.9 | -0.8 | -1.1 | 0.1 |
| p-değeribir | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | - |
| FPG (mg / dL) | (N = 126) | (118) | (N = 120), | (N = 132) | (N = 122), | (N = 113) |
| Temel | 182.7 | 183.7 | 178.9 | 181.0 | 181.6 | 179.6 |
| FİNAL ZİYARETTE Değişiklik | -15.2 | -19.3 | -28.5 | -29.9 | -33.6 | 7.6 |
| p-değeribir | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | - |
| Vücut Ağırlığı (lbs) | (N = 125) | (N = 119) | (N = 117) | (N = 131), | (N = 119) | (N = 113) |
| Temel | 192.9 | 191.8 | 188.3 | 195.4 | 192.5 | 194.3 |
| FİNAL ZİYARETTE Değişiklik | -1.3 | -1.3 | -0.7 | -1.5 | -2.2 | -1.8 |
| p-değeribir | NS ** | NS ** | NS ** | NS ** | NS ** | - |
Plasebo ile karşılaştırıldığında, Glucophage XR'nin (metformin) tüm doz seviyelerinde glisemik kontrolde iyileşme görüldü Uzun Süreli Salım Tabletleri ve tedavisi, ağırlıkta önemli bir değişiklik ile ilişkili değildi (görmek KULLANIM ŞEKLİ VE DOZU Glucophage ve Glucophage XR için doz önerileri için).
Glucophage XR'nin akşam yemeği ile günde bir kez alınan Glükofaj (metformin hidroklorür) Tabletleri ile günde iki kez alınan 24 haftalık, çift kör, randomize bir çalışma kahvaltı ve akşam yemeği), çalışmaya başlamadan önce en az 8 hafta boyunca günde iki kez 500 mg Glukofaj ile tedavi edilen tip 2 diyabetli hastalara uygulandı. Glukofaj dozu, çalışmaya girmeden önce belirli bir glisemik kontrol seviyesine ulaşmak için titre edilmiş değildi. HbA1c ‰ ¤% 8.5.5 ve FPG 200 ‰ ¤ 200 mg / dL ise hastalar çalışmaya hak kazandı. Glisemik kontrol ve vücut ağırlığındaki değişiklikler Tablo 7'de gösterilmiştir.
Tablo 7: HbA'da Taban Çizgisinden * Ortalama Değişikliklerin Özeti1c12. Haftada ve Son Ziyarette Oruç, Açlık Plazma Glikozu ve Vücut Ağırlığı (24 haftalık çalışma)
| Glucophage 500 mg Günde iki kez |
Glukofaj XR | ||
|---|---|---|---|
| 1000 mg Günde bir kez |
1500 mg Günde bir kez |
||
| * Glucophage kullanan tüm hastalar Başlangıçta günde iki kez 500 mg | |||
| bir n = 68 | |||
| Hemoglobin A1c (%) | (N = 67) | (N = 72), | (N = 66) |
| Temel | 7.06 | 6.99 | 7.02 |
| 12 Haftada Değişim | 0.14 | 0.23 | 0.04 |
| (% 95 CI) | (-0.03, 0.31) | (0.10, 0.36) | (-0.08, 0.15) |
| FİNAL ZİYARETTE Değişiklik | 0.14bir | 0.27 | 0.13 |
| (% 95 CI) | (-0.04, 0.31) | (0.11, 0.43) | (-0.02, 0.28) |
| FPG (mg / dL) | (N = 69) | (N = 72), | (N = 70), |
| Temel | 127.2 | 131.0 | 131.4 |
| 12 Haftada Değişim | 12.9 | 9.5 | 3.7 |
| (% 95 CI) | (6.5, 19.4) | (4.4, 14.6) | (-0.4, 7.8) |
| FİNAL ZİYARETTE Değişiklik | 14.0 | 11.5 | 7.6 |
| (% 95 CI) | (7.0, 21.0) | (4.4, 18.6) | (1.0, 14.2) |
| Vücut Ağırlığı (lbs) | (N = 71) | (N = 74) | (N = 71) |
| Temel | 210.3 | 202.8 | 192.7 |
| 12 Haftada Değişim | 0.4 | 0.9 | 0.7 |
| (% 95 CI) | (-0.4, 1.5) | (0.0, 2.0) | (-0.4, 1.8) |
| FİNAL ZİYARETTE Değişiklik | 0.9 | 1.1 | 0.9 |
| (% 95 CI) | (-0.4, 2.2) | (-0.2, 2.4) | (-0.4, 2.0) |
12 haftalık tedaviden sonra ortalama HbA'da bir artış oldu1c tüm gruplarda; Glucophage XR 1000 mg grubunda başlangıçtan% 0.23 artış istatistiksel olarak anlamlıydı (bkz. KULLANIM ŞEKLİ VE DOZU).
Glukofaj XR'nin daha önce tarif edilen plasebo kontrollü doz-cevap çalışmasındaki lipit parametrelerindeki değişiklikler Tablo 8'de gösterilmektedir.
Tablo 8: Son Ziyarette Başlıca Lipid Değişkenlerinde Başlangıçta * Ortalama Yüzde Değişikliklerin Özeti (16 haftalık çalışma)
| Glukofaj XR | plasebo | |||||
|---|---|---|---|---|---|---|
| 500 mg bir Zamanlar Günlük |
1000 mg bir Zamanlar Günlük |
1500 mg bir Zamanlar Günlük |
2000 mg bir Zamanlar Günlük |
1000 mg İki defa Günlük |
||
| * Başlangıçta diyet tedavisi alan tüm hastalar | ||||||
| Toplam Kolesterol (mg / dL) | (N = 120), | (N = 113) | (N = 110), | (N = 126) | (N = 117) | (N = 110), |
| Temel | 210.3 | 218.1 | 214.6 | 204.4 | 208.2 | 208.6 |
| FİNAL ZİYARETTE Ortalama% Değişim | 1.0% | 1.7% | 0.7% | -1.6% | -2.6% | 2.6% |
| Toplam Trigliseritler (mg / dL) | (N = 120), | (N = 113) | (N = 110), | (N = 126) | (N = 117) | (N = 110), |
| Temel | 220.2 | 211.9 | 198.0 | 194.2 | 179.0 | 211.7 |
| FİNAL ZİYARETTE Ortalama% Değişim | 14.5% | 9.4% | 15.1% | 14.9% | 9.4% | 10.9% |
| LDL-Kolesterol (mg / dL) | (N = 119) | (N = 113) | (N = 109) | (N = 126) | (N = 117) | (N = 107), |
| Temel | 131.0 | 134.9 | 135.8 | 125.8 | 131.4 | 131.9 |
| FİNAL ZİYARETTE Ortalama% Değişim | -1.4% | -1.6% | -3.5% | -3.3% | -5.5% | 3.2% |
| HDL-Kolesterol (mg / dL) | (N = 120), | (N = 108), | (N = 108), | (N = 125) | (N = 117) | (N = 108), |
| Temel | 40.8 | 41.6 | 40.6 | 40.2 | 42.4 | 39.4 |
| FİNAL ZİYARETTE Ortalama% Değişim | 6.2% | 8.6% | 5.5% | 6.1% | 7.1% | 5.8% |
Glucophage ve Glucophage XR'nin daha önce tarif edilen çalışmasında lipit parametrelerindeki değişiklikler Tablo 9'da gösterilmiştir.
Tablo 9: Son Ziyarette Başlıca Lipid Değişkenlerinde Başlangıçta * Ortalama Yüzde Değişikliklerin Özeti (24 haftalık çalışma)
| Glucophage | Glukofaj XR | ||
|---|---|---|---|
| 500 mg Günde iki kez |
1000 mg Günde bir kez |
1500 mg Günde bir kez |
|
| * Glucophage kullanan tüm hastalar Başlangıçta günde iki kez 500 mg | |||
| Toplam Kolesterol (mg / dL) | (N = 68) | (N = 70), | (N = 66) |
| Temel | 199.0 | 201.9 | 201.6 |
| FİNAL ZİYARETTE Ortalama% Değişim | 0.1% | 1.3% | 0.1% |
| Toplam Trigliseritler (mg / dL) | (N = 68) | (N = 70), | (N = 66) |
| Temel | 178.0 | 169.2 | 206.8 |
| FİNAL ZİYARETTE Ortalama% Değişim | 6.3% | 25.3% | 33.4% |
| LDL-Kolesterol (mg / dL) | (N = 68) | (N = 70), | (N = 66) |
| Temel | 122.1 | 126.2 | 115.7 |
| FİNAL ZİYARETTE Ortalama% Değişim | −1.3% | −3.3% | −3.7% |
| HDL-Kolesterol (mg / dL) | (N = 68) | (N = 70), | (N = 65) |
| Temel | 41.9 | 41.7 | 44.6 |
| FİNAL ZİYARETTE Ortalama% Değişim | 4.8% | 1.0% | -2.1% |
Pediatrik Klinik Çalışmalar
Tip 2 diyabetli (ortalama FPG 182.2 mg / dL) 10 ila 16 yaş arasındaki pediyatrik hastalarda çift kör, plasebo kontrollü bir çalışmada Glukofaj tedavisi (2000'e kadar) mg / gün) 16 haftaya kadar (ortalama tedavi süresi 11 hafta), FPG'de plasebo ile karşılaştırıldığında 64.3 mg / dL'de anlamlı bir ortalama net azalma ile sonuçlandı (bkz. Tablo 10).
Tablo 10: Glukofaj ve Plasebo (Pediatri)bir) Son Ziyarette Plazma Glikozu ve Vücut Ağırlığında Başlangıçtan * Ortalama Değişimlerin Özeti
| Glucophage | plasebo | p-Değeri | |
|---|---|---|---|
| bir Pediyatrik hastalar ortalama yaş 13.8 yıl (dağılım 10-16 yıl) | |||
| * Başlangıçta diyet tedavisi alan tüm hastalar | |||
| ** İstatistiksel olarak anlamlı değil | |||
| FPG (mg / dL) | (N = 37) | (N = 36) | |
| Temel FİNAL ZİYARETTE Değişiklik |
162.4 -42.9 |
192.3 21.4 |
<0.001 |
| Vücut Ağırlığı (lbs) | (N = 39) | (N = 38), | |
| Temel FİNAL ZİYARETTE Değişiklik |
205.3 -3.3 |
189.0 -2.0 |
NS ** |
üst
Göstergeler ve kullanımları
Glukofaj (metformin hidroklorür) Tabletler, yetişkinlerde ve tip 2 diyabetes mellituslu çocuklarda glisemik kontrolü geliştirmek için diyet ve egzersize ek olarak endikedir.
Glukofaj XR (metformin hidroklorür) Uzun Süreli Salınımlı Tabletler, tip 2 diyabetes mellituslu yetişkinlerde glisemik kontrolü iyileştirmek için diyet ve egzersize ek olarak endikedir.
üst
Kontrendikasyonlar
Glucophage ve Glucophage XR kontrendikedir:
Böbrek hastalığı veya böbrek fonksiyon bozukluğu (örn., Serum kreatinin düzeylerinin önerdiği gibi â ‰ ¥ 1,5 mg / dL [erkek], â ‰ ¥ 1,4 mg / dL [kadın] veya anormal kreatinin klerensi) kardiyovasküler kollaps (şok), akut miyokard enfarktüsü ve septisemi gibi durumlardan kaynaklanabilir. (görmek UYARILAR ve ÖNLEMLER).
Metformin hidroklorüre bilinen aşırı duyarlılık.
Diyabetik ketoasidoz dahil, koma ile veya koma olmadan akut veya kronik metabolik asidoz. Diyabetik ketoasidoz insülin ile tedavi edilmelidir.
Glucophage ve Glucophage XR, aşağıdakileri içeren radyolojik çalışmalar geçiren hastalarda geçici olarak kesilmelidir. iyotlu kontrast materyallerin intravasküler uygulaması, çünkü bu tür ürünlerin kullanımı, akut değişikliklere neden olabilir. böbrek fonksiyonu. (Ayrıca bakınız ÖNLEMLER.)
üst
Uyarılar
Laktik asit:
Laktik asidoz, Glucophage veya Glucophage XR tedavisi sırasında metformin birikimi nedeniyle ortaya çıkabilecek nadir, ancak ciddi bir metabolik komplikasyondur; meydana geldiğinde, vakaların yaklaşık% 50'sinde ölümcüldür. Laktik asidoz, diyabetes mellitus dahil olmak üzere bir dizi patofizyolojik durumla ilişkili olarak ve önemli doku hipoperfüzyonu ve hipoksemi olduğunda da ortaya çıkabilir. Laktik asidoz, yüksek kan laktat seviyeleri (> 5 mmol / L), azalmış kan pH'ı, artmış anyon boşluğu olan elektrolit bozuklukları ve artan laktat / piruvat oranı ile karakterizedir. Metformin laktik asidozun nedeni olarak belirtildiğinde, genellikle 5 ug / mL'den büyük metformin plazma seviyeleri bulunur.
Metformin hidroklorür alan hastalarda bildirilen laktik asidoz insidansı çok düşüktür (yaklaşık 0.03 vaka / 1000 hasta yılı, yaklaşık 0.015 ölümcül vaka / 1000 Hasta-yıl). Klinik çalışmalarda 20.000'den fazla hasta yılı metformine maruz kaldığında, laktik asidoz bildirilmemiştir. Bildirilen vakalar, esas olarak her iki intrinsik böbrek de dahil olmak üzere önemli böbrek yetmezliği olan diyabetik hastalarda ortaya çıkmıştır hastalık ve böbrek hipoperfüzyonu, genellikle birden fazla eşlik eden tıbbi / cerrahi problem ve birden fazla eşlik eden ortamda ilaçlar. Farmakolojik tedavi gerektiren konjestif kalp yetmezliği olan hastalar, özellikle kararsız veya hipoperfüzyon ve hipoksemi riski taşıyan akut konjestif kalp yetmezliği, artmış laktik riski altındadır asidoz. Laktik asidoz riski, böbrek fonksiyon bozukluğu derecesi ve hastanın yaşı ile artar. Bu nedenle laktik asidoz riski, böbrek fonksiyonlarının düzenli olarak izlenmesi ile önemli ölçüde azaltılabilir. Glucophage veya Glucophage XR alan ve minimum etkili Glucophage veya Glucophage dozunu kullanan hastalar XR. Özellikle yaşlıların tedavisine böbrek fonksiyonlarının dikkatle izlenmesi eşlik etmelidir. Kreatinin ölçümü yapılmadığı sürece 80 yaşından büyük hastalarda Glucofage veya Glucophage XR tedavisi başlatılmamalıdır. klerens, bu hastalar laktik gelişmeye daha duyarlı olduğu için böbrek fonksiyonunun azalmadığını gösterir. asidoz. Ek olarak, Glukofaj ve Glukofaj XR, hipoksemi, dehidrasyon veya sepsis ile ilişkili herhangi bir durumun varlığında derhal durdurulmalıdır. Çünkü karaciğer fonksiyon bozukluğu laktat, Glukofaj ve Hepatik klinik veya laboratuvar kanıtı olan hastalarda glukofaj XR'den genellikle kaçınılmalıdır. hastalığı. Hastalar, alırken akut veya kronik aşırı alkol alımına karşı uyarılmalıdır. Glucophage veya Glucophage XR, çünkü alkol metformin hidroklorürün laktat üzerindeki etkilerini güçlendirir metabolizma. Ek olarak, herhangi bir intravasküler radyokontrast çalışmasından önce ve herhangi bir cerrahi prosedür için Glucophage ve Glucophage XR geçici olarak kesilmelidir (ayrıca bkz. ÖNLEMLER).
Laktik asidozun başlangıcı genellikle incedir ve sadece halsizlik, miyalji, solunum sıkıntısı, artan uyku hali ve spesifik olmayan abdominal sıkıntı gibi spesifik olmayan semptomlar eşlik eder. Daha belirgin asidoz ile ilişkili hipotermi, hipotansiyon ve dirençli bradiaritmiler olabilir. Hasta ve hastanın doktoru, bu tür semptomların olası öneminin farkında olmalı ve hasta ortaya çıkarsa derhal doktora haber vermesi konusunda bilgilendirilmelidir (ayrıca bkz. ÖNLEMLER). Glucophage ve Glucophage XR, durum netleşene kadar geri çekilmelidir. Serum elektrolitleri, ketonlar, kan şekeri ve belirtilirse, kan pH'ı, laktat seviyeleri ve hatta kan metformin seviyeleri yararlı olabilir. Bir hasta herhangi bir Glucophage veya Glucophage XR doz seviyesinde stabilize edildiğinde, tedavinin başlatılması sırasında yaygın olan gastrointestinal semptomların ilaca bağlı olması olası değildir. Daha sonra gastrointestinal semptomların ortaya çıkması laktik asidoz veya diğer ciddi hastalıklardan kaynaklanabilir.
Glucophage veya Glucophage XR alan hastalarda açlık venöz plazma laktat seviyesinin normalin üst sınırının üstünde, ancak 5 mmol / L'den az olması mutlaka belirtmez Yaklaşan laktik asidozdur ve zayıf kontrollü diyabet veya obezite, kuvvetli fiziksel aktivite veya örnekteki teknik problemler gibi diğer mekanizmalarla açıklanabilir. taşıma. (Ayrıca bakınız ÖNLEMLER.)
Ketoasidoz (ketonüri ve ketonemi) kanıtı olmayan metabolik asidozu olan herhangi bir diyabetik hastada laktik asidozdan şüphelenilmelidir.
Laktik asidoz, bir hastane ortamında tedavi edilmesi gereken tıbbi bir acil durumdur. Glucophage veya Glucophage XR alan laktik asidozlu bir hastada ilaç derhal kesilmeli ve derhal genel destekleyici önlemler alınmalıdır. Metformin hidroklorür diyaliz edilebilir olduğundan (iyi hemodinamik altında 170 mL / dakikaya kadar açıklık ile) koşullar), asidozu düzeltmek ve birikenleri çıkarmak için hızlı hemodiyaliz önerilir metformin. Böyle bir yönetim genellikle semptomların derhal geri dönmesine ve iyileşmesine neden olur. (Ayrıca bakınız KONTRENDİKASYONLARI ve ÖNLEMLER.)
üst
Önlemler
Genel
Makrovasküler Sonuçlar — Glucophage veya Glucophage XR veya başka herhangi bir antidiyabetik ilaç ile makrovasküler risk azaltımına dair kesin kanıtlar sunan klinik çalışma yapılmamıştır.
Böbrek fonksiyonunun izlenmesi - Metforminin böbrek tarafından önemli ölçüde atılımı bilinir ve böbrek yetmezliği derecesi ile metformin birikimi ve laktik asidoz riski artar işlevi. Bu nedenle, yaşları için serum üst kreatinin seviyeleri normalin üst sınırının üstünde olan hastalara Glucophage veya Glucophage XR verilmemelidir. İleri yaştaki hastalarda, Glucophage ve Glucophage XR dikkatlice titre edilmelidir. yaşlanma azalmış böbrek ile ilişkili olduğu için yeterli glisemik etki için minimum doz işlevi. Yaşlı hastalarda, özellikle de 80 yaş ve üzerindeki hastalarda, böbrek fonksiyonları düzenli olarak izlenmeli ve genellikle Glükofaj ve Glükofaj XR maksimum doza titre edilmemelidir (bkz. UYARILAR ve KULLANIM ŞEKLİ VE DOZU).
Glucophage veya Glucophage XR tedavisine başlamadan önce ve en az yılda bir kez böbrek fonksiyonları normal olarak değerlendirilmeli ve doğrulanmalıdır. Böbrek fonksiyon bozukluğu gelişmesi beklenen hastalarda böbrek fonksiyonu değerlendirilmelidir. Böbrek yetmezliği kanıtı varsa Glucophage veya Glucophage XR kesilir mevcut.
Böbrek fonksiyonunu veya metformin düzenini etkileyebilecek eşlik eden ilaçların kullanımı — Böbrek fonksiyonunu etkileyebilecek veya önemli hemodinamik değişiklik veya böbrek tübüler sekresyonu ile ortadan kaldırılan katyonik ilaçlar gibi metformin düzenine müdahale edebilir (bkz. ÖNLEMLER: İlaç Etkileşimleri), dikkatle kullanılmalıdır.
Damar içi iyotlu kontrast materyallerinin kullanımını içeren radyolojik çalışmalar (örneğin, intravenöz ürogram, intravenöz damar içi kontrast materyalleri ile kolanjiyografi, anjiyografi ve bilgisayarlı tomografi (BT) taramaları) iyotlu malzemeler böbrek fonksiyonlarında akut değişikliğe neden olabilir ve alan hastalarda laktik asidoz ile ilişkilendirilmiştir. metformin (bkz. KONTRENDİKASYONLARI). Bu nedenle, böyle bir çalışmanın planlandığı hastalarda, Glükofaj veya Glukofaj XR, çalışma sırasında veya öncesinde geçici olarak kesilmelidir. işlemden sonra 48 saat süreyle alıkonuldu ve sadece böbrek fonksiyonu yeniden değerlendirildikten ve normal.
Hipoksik durumlar — Sebep ne olursa olsun kardiyovasküler kollaps (şok), akut konjestif kalp yetmezliği, akut miyokardiyal enfarktüs ve hipoksemi ile karakterize diğer durumlar laktik asidoz ile ilişkilendirilmiştir ve ayrıca neden olabilir prerenal azotemi. Glucophage veya Glucophage XR tedavisi gören hastalarda bu tür olaylar meydana geldiğinde, ilaç derhal kesilmelidir.
Cerrahi prosedürler — Glucophage veya Glucophage XR tedavisi herhangi bir cerrahi prosedür için geçici olarak askıya alınmalıdır (ilişkili olmayan küçük prosedürler hariç) gıda ve sıvı alımının kısıtlı olması) ve hastanın oral alımı devam edene ve böbrek fonksiyonu aşağıdaki gibi değerlendirilmeden yeniden başlatılmamalıdır. normal.
Alkol alımı — Alkolün metforminin laktat metabolizması üzerindeki etkisini arttırdığı bilinmektedir. Bu nedenle hastalar, Glucophage veya Glucophage XR alırken akut veya kronik aşırı alkol alımına karşı uyarılmalıdır.
Karaciğer fonksiyon bozukluğu - Karaciğer fonksiyon bozukluğu bazı laktik asidoz vakalarıyla ilişkili olduğundan, Glukofaj ve Glucophage XR'den klinik veya laboratuvar hepatik kanıtı olan hastalarda genellikle kaçınılmalıdır. hastalığı.
B12 Vitamini Seviyeleri — 29 haftalık Glukofaj kontrollü klinik çalışmalarda, subnormal seviyelerde bir azalma Daha önce normal serum vitamin B12 seviyeleri, klinik belirtiler olmadan, yaklaşık% 7 oranında gözlenmiştir. Hastalar. Bununla birlikte, muhtemelen B12-intrinsik faktör kompleksinden B12 emilimine müdahale nedeniyle bu azalma çok nadiren anemi ile ilişkilidir ve Glukofaj veya B12 vitamininin kesilmesi ile hızlı bir şekilde geri dönüşümlü olduğu görülmektedir. takviyesi. Glucophage veya Glucophage XR hastalarında hematolojik parametrelerin yıllık bazda ölçülmesi tavsiye edilir ve görünen anormallikler uygun şekilde araştırılmalı ve yönetilmelidir (bkz. ÖNLEMLER: Laboratuvar testleri).
Bazı bireyler (yetersiz B12 vitamini veya kalsiyum alımı veya emilimi olanlar) subnormal B12 vitamini düzeylerini geliştirmeye yatkın görünmektedir. Bu hastalarda, 2 ila 3 yıllık aralıklarla rutin serum B12 vitamini ölçümleri yararlı olabilir.
Daha önce kontrol edilen tip 2 diyabetli hastaların klinik durumundaki değişiklik - Daha önce Glucophage veya Glucophage XR üzerinde iyi kontrol edilen tip 2 diyabetli bir hasta laboratuvar anormallikleri veya klinik hastalık geliştirir (özellikle belirsiz ve kötü tanımlanmış hastalık) ketoasidoz veya laktik kanıt için derhal değerlendirilmelidir asidoz. Değerlendirme serum elektrolitlerini ve ketonları, kan şekerini ve belirtilirse kan pH'sını, laktat, piruvat ve metformin seviyelerini içermelidir. Her iki formdan birinin asidozu meydana gelirse, Glucophage veya Glucophage XR derhal durdurulmalı ve diğer uygun düzeltici önlemler başlatılmalıdır (ayrıca bkz. UYARILAR).
Hipoglisemi — Hipoglisemi, normal kullanım koşulları altında yalnızca Glükofaj veya Glukofaj XR alan hastalarda ortaya çıkmaz, ancak kalori alımı olduğunda ortaya çıkabilir. yorucu egzersiz kalori takviyesi ile telafi edilmediğinde veya diğer glikoz düşürücü ajanlarla (sülfonilüreler ve insülin gibi) birlikte kullanılması durumunda eksik veya etanoldur.
Yaşlı, zayıflamış veya yetersiz beslenmiş hastalar ve adrenal veya hipofiz yetmezliği veya alkol zehirlenmesi olan hastalar hipoglisemik etkilere özellikle duyarlıdır. Hipogliseminin yaşlılarda ve beta-adrenerjik bloke edici ilaçlar alan kişilerde tanınması zor olabilir.
Kan şekerinin kontrol kaybı - Diyabetik rejimde stabilize edilen bir hasta ateş, travma, enfeksiyon veya cerrahi gibi strese maruz kaldığında geçici bir glisemik kontrol kaybı meydana gelebilir. Bu gibi zamanlarda, Glükofaj veya Glukofaj XR'yi alıkoymak ve geçici olarak insülin uygulamak gerekebilir. Akut atak çözüldükten sonra glukofaj veya Glükofaj XR yeniden kullanılabilir.
Oral antidiyabetik ilaçların kan glikozunu hedeflenen seviyeye düşürmedeki etkinliği, birçok hastada bir süre boyunca azalır. Altta yatan hastalığın ilerlemesinden veya ilaca karşı azalan yanıttan kaynaklanabilecek bu fenomen, İkincil başarısızlık olarak bilinen, ilacın ilk tedavi sırasında etkisiz olduğu birincil başarısızlıktan ayırt edilmesi. Glucophage veya Glucophage XR veya sulfonylurea monoterapisi ile ikincil başarısızlık meydana gelirse, Glucophage veya Glucophage XR ve sulfonylurea ile kombine tedavi yanıt verebilir. Kombine Glükofaj / sülfonilüre tedavisi veya Glükofaj ile ikincil başarısızlık meydana gelirse XR / sülfonilüre tedavisi, başlangıcı da dahil olmak üzere terapötik alternatifleri dikkate almak gerekebilir. insülin tedavisi.
Hastalar için Bilgiler
Hastalar, Glucophage veya Glucophage XR'nin potansiyel riskleri ve yararları ve alternatif tedavi modları hakkında bilgilendirilmelidir. Ayrıca, diyet talimatlarına uymanın önemi, düzenli bir egzersiz hakkında da bilgilendirilmelidirler. programı ve kan şekeri, glikosile hemoglobin, böbrek fonksiyonu ve hematolojik testlerin düzenli olarak yapılması parametreleri.
Laktik asidoz riskleri, belirtileri ve gelişimine yatkın durumlar, UYARILAR ve ÖNLEMLER bölümler, hastalara açıklanmalıdır. Hastalara Glucophage veya Glucophage XR'yi derhal bırakmaları ve derhal sağlıklarını bildirmeleri tavsiye edilmelidir. açıklanamayan hiperventilasyon, kas ağrısı, halsizlik, olağandışı uyku hali veya diğer spesifik olmayan semptomlar varsa uygulayıcı meydana gelir. Bir hasta herhangi bir Glucophage veya Glucophage XR doz seviyesinde stabilize edildikten sonra, metformin tedavisinin başlatılması sırasında yaygın olan gastrointestinal semptomların ilaca bağlı olması olası değildir. Daha sonra gastrointestinal semptomların ortaya çıkması laktik asidoz veya diğer ciddi hastalıklardan kaynaklanabilir.
Glucophage veya Glucophage XR alırken hastalara akut veya kronik aşırı alkol alımına karşı danışmanlık yapılmalıdır.
Glucophage veya Glucophage XR tek başına genellikle hipoglisemiye neden olmaz, ancak Glucophage veya Glucophage XR oral sülfonilüreler ve insülin ile birlikte kullanıldığında ortaya çıkabilir. Kombinasyon tedavisine başlarken hipoglisemi riskleri, belirtileri ve tedavisi ve gelişimine yatkın koşullar hastalara ve sorumlu aileye açıklanmalıdır üyeler.
Hastalara Glucophage XR'nin bütün olarak yutulması, ezilmemesi veya çiğnenmemesi gerektiği ve aktif olmayan bileşenler bazen dışkıda orijinaline benzeyen yumuşak bir kütle olarak elimine edilebilir. tablet.
Laboratuvar testleri
Tüm diyabetik tedavilere yanıt, açlık kanının periyodik ölçümleri ile izlenmelidir. glikoz ve glikosile hemoglobin seviyeleri, bu seviyeleri normal seviyeye düşürmek Aralık. Başlangıç doz titrasyonu sırasında, terapötik yanıtı belirlemek için açlık glikozu kullanılabilir. Daha sonra, hem glikoz hem de glikosile edilmiş hemoglobin izlenmelidir. Glikosile hemoglobin ölçümleri özellikle uzun süreli kontrolün değerlendirilmesinde yararlı olabilir (ayrıca bkz. KULLANIM ŞEKLİ VE DOZU).
Hematolojik parametrelerin (hemoglobin / hematokrit ve kırmızı kan) ilk ve periyodik olarak izlenmesi hücre indeksleri) ve böbrek fonksiyonu (serum kreatinin) en az yıllık bazda gerçekleştirilmelidir. Glukofaj tedavisi ile megaloblastikanemi nadiren görülürken, bundan şüpheleniliyorsa, B12 vitamini eksikliği hariç tutulmalıdır.
İlaç Etkileşimleri (Glukofaj ile İletilen İlaç Etkileşimlerinin Klinik Değerlendirmesi)
Glyburide — Tip 2 diyabet hastalarında yapılan tek dozluk bir etkileşim çalışmasında, metformin ve gliburid, metformin farmakokinetiğinde veya farmakodinami. Gliburit EAA ve Cmaks'ta azalma gözlendi, ancak oldukça değişkendi. Bu çalışmanın tek dozlu doğası ve gliburid kan düzeyleri ile farmakodinamik etkiler arasındaki korelasyon eksikliği, bu etkileşimin klinik önemini belirsiz kılmaktadır (bkz. KULLANIM ŞEKLİ VE DOZU: Eşlik eden Glukofaj veya Glukofaj XR ve Yetişkin Hastalarda Oral Sülfonilüre Tedavisi).
Furosemid — Sağlıklı kişilerde tek doz, metformin-furosemid ilaç etkileşimi çalışması, her iki bileşiğin farmakokinetik parametrelerinin birlikte uygulamadan etkilendiğini göstermiştir. Furosemid, metformin renal klerensinde önemli bir değişiklik olmadan metformin plazma ve kan Cmax'ı% 22 ve kan AUC'sini% 15 arttırdı. Metformin ile uygulandığında, furosemidin Cmax ve AUC değerleri, sırasıyla% 31 ve% 12 daha küçüktü. tek başına uygulanır ve terminal yarı ömrü furosemid renalde anlamlı bir değişiklik olmadan% 32 azalır Boşluk. Kronik olarak birlikte uygulandığında metformin ve furosemidin etkileşimi hakkında bilgi mevcut değildir.
Nifedipin — Normal sağlıklı gönüllülerde tek doz, metformin-nifedipin ilaç etkileşimi çalışması göstermiştir. nifedipinin birlikte uygulanması plazma metformin Cmax ve AUC'yi sırasıyla% 20 ve% 9 artırdı ve miktarı arttırdı idrarla atılır. Tmax ve yarılanma ömrü etkilenmedi. Nifedipinin metformin emilimini arttırdığı görülmektedir. Metforminin nifedipin üzerinde minimal etkileri vardı.
Katyonik ilaçlar — Katyonik ilaçlar (ör. Amilorid, digoksin, morfin, prokainamid, kinidin, kinin, ranitidin, triamteren, trimetoprim veya vankomisin) böbrek tübüler sekresyonu ile ortadan kaldırılır teorik olarak ortak renal tübüler nakil için rekabet ederek metformin ile etkileşim potansiyeline sahiptir sistemleri. Metformin ve oral simetidin arasındaki bu etkileşim normal sağlıklı gönüllülerde hem tek hem de çok dozlu metformin-simetidinde gözlenmiştir. doruk metformin plazması ve tam kan konsantrasyonlarında% 60 artış ve plazma ve tam kan metforminde% 40 artış ile ilaç etkileşimi çalışmaları AUC. Tek dozlu çalışmada eliminasyon yarılanma ömründe bir değişiklik olmamıştır. Metforminin simetidin farmakokinetiği üzerinde hiçbir etkisi yoktu. Her ne kadar bu etkileşimler teorik kalsa da (simetidin hariç), dikkatli hasta izleme ve Glükofaj veya Glükofaj XR doz ayarlaması ve / veya etkileşen ilacın proksimal renal tübüler sekretuar yoluyla atılan katyonik ilaçlar alan hastalarda önerilmesi sistemi.
Diğer — Bazı ilaçlar hiperglisemi üretme eğilimindedir ve glisemik kontrol kaybına yol açabilir. Bu ilaçlar arasında tiazidler ve diğer diüretikler, kortikosteroidler, fenotiyazinler, tiroid ürünleri, östrojenler, oral kontraseptifler, fenitoin, nikotinik asit, sempatomimetikler, kalsiyum kanalı bloke edici ilaçlar ve izoniazid. Glucophage veya Glucophage XR alan bir hastaya bu tür ilaçlar uygulandığında, hasta kan şekeri kontrolünün kaybı açısından yakından izlenmelidir. Glucophage veya Glucophage XR alan bir hastadan bu tür ilaçlar çekildiğinde, hasta hipoglisemi açısından yakından izlenmelidir.
Sağlıklı gönüllülerde, tek doz etkileşim çalışmalarında birlikte uygulandığında metformin ve propranolol ve metformin ve ibuprofen farmakokinetiği etkilenmemiştir.
Metformin ihmal edilebilir bir şekilde plazma proteinlerine bağlıdır ve bu nedenle, saliselatlar, sülfonamidler, kloramfenikol ve probenesid, sülfonilürelere kıyasla, seruma yoğun olarak bağlanır proteinler.
Karsinogenez, Mutajenez, Doğurganlık Bozukluğu
Sıçanlarda (104 haftalık dozlama süresi) ve farelerde uzun süreli karsinojenite çalışmaları yapılmıştır. 900 mg / kg / gün ve 1500 mg / kg / gün dahil dozlarda (91 haftalık dozlama süresi), sırasıyla. Bu dozlar, vücut yüzey alanı karşılaştırmalarına dayanarak, önerilen maksimum günlük 2000 mg'lık insan dozunun yaklaşık 4 katıdır. Erkek veya dişi farelerde metformin ile karsinojenite kanıtı bulunamadı. Benzer şekilde, erkek sıçanlarda metformin ile hiçbir tümörjenik potansiyel gözlenmemiştir. Bununla birlikte, 900 mg / kg / gün ile tedavi edilen dişi sıçanlarda iyi huylu stromal uterin polip insidansı artmıştır.
Aşağıdaki in vitro testlerde metforminin mutajenik potansiyeline dair bir kanıt yoktu: Ames testi (S. typhimurium), gen mutasyon testi (fare lenfoma hücreleri) veya kromozomal anormallikler testi (insan lenfositleri). İn vivo fare mikronükleus testindeki sonuçlar da negatifti.
Erkek veya dişi sıçanların doğurganlığı, 600'e kadar olan dozlarda uygulandığında metforminden etkilenmedi mg / kg / gün, vücut yüzey alanına göre önerilen maksimum insan günlük dozunun yaklaşık 3 katı karşılaştırmaları.
Gebelik
Teratojenik Etkiler: Gebelik Kategorisi B
Son bilgiler, hamilelik sırasında anormal kan şekeri seviyelerinin daha yüksek konjenital anormallik insidansı ile ilişkili olduğunu kuvvetle göstermektedir. Çoğu uzman, kan şekeri seviyelerini mümkün olduğunca normale yakın tutmak için hamilelik sırasında insülinin kullanılmasını önerir. Hayvan üreme çalışmaları her zaman insan tepkisini öngörmediğinden, açıkça gerekmedikçe Glucophage ve Glucophage XR hamilelik sırasında kullanılmamalıdır.
Glucophage veya Glucophage XR olan gebe kadınlarda yeterli ve iyi kontrollü bir çalışma yoktur. Metformin, sıçanlarda ve tavşanlarda 600 mg / kg / gün'e kadar dozlarda teratojenik değildi. Bu, sıçanlar ve tavşanlar için vücut yüzey alanı karşılaştırmaları temelinde önerilen maksimum insan günlük 2000 mg'lık dozun yaklaşık 2 ve 6 katı bir maruziyeti temsil eder. Fetal konsantrasyonların belirlenmesi metformine karşı kısmi bir plasental bariyer gösterdi.
Emziren Anneler
Emziren sıçanlarda yapılan çalışmalar, metforminin sütün içine atıldığını ve plazmayla karşılaştırılabilir seviyelere ulaştığını göstermektedir. Emziren annelerde benzer çalışmalar yapılmamıştır. Emziren bebeklerde hipoglisemi potansiyeli olabileceğinden, ilacın önemini göz önünde bulundurarak hemşireliği bırakma veya ilacı bırakma annesi. Glucophage veya Glucophage XR kesilirse ve tek başına diyet kan şekerini kontrol etmek için yetersizse, insülin tedavisi düşünülmelidir.
Pediyatrik Kullanım
Glukofajın tip 2 diyabet tedavisi için güvenliği ve etkinliği, 10 ila 16 yaş arasındaki pediyatrik hastalar (10 yaş altı pediyatrik hastalarda çalışma yapılmamıştır. yıl). Bu yaş grubunda Glükofaj kullanımı, yetişkinlerde Glucophage'ın yeterli ve iyi kontrol edilen çalışmalarından elde edilen kanıtlarla desteklenir. Tip 2 diyabetli 10 ila 16 yaş arasındaki pediyatrik hastalarda kontrollü klinik çalışma, glisemik kontrolde görülenlere benzer bir tepki gösterdi. yetişkinler. (Görmek KLİNİK FARMAKOLOJİ: Pediatrik Klinik Çalışmalar.) Bu çalışmada, yan etkiler yetişkinlerde açıklananlara benzerdi. (Görmek TERS TEPKİLER: Pediatrik Hastalar.) Maksimum günlük 2000 mg doz önerilir. (Görmek KULLANIM ŞEKLİ VE DOZU: Önerilen Doz Çizelgesi: Pediatri.)
Pediatrik hastalarda Glucophage XR'nin güvenliği ve etkinliği belirlenmemiştir.
Geriyatrik Kullanım
Glucophage ve Glucophage XR'nin kontrollü klinik çalışmaları, yanıt verip vermediklerini belirlemek için yeterli sayıda yaşlı hasta içermedi bildirilen diğer klinik deneyimler yaşlılar ve gençler arasındaki yanıtlardaki farklılıkları tanımlamamasına rağmen, genç hastalardan farklı olarak Hastalar. Metforminin böbrek tarafından önemli ölçüde atıldığı bilinmektedir ve ilaca ciddi advers reaksiyon riski daha büyüktür Böbrek fonksiyon bozukluğu olan hastalarda, Glukofaj ve Glukofaj XR sadece normal böbrek fonksiyonu olan hastalarda kullanılmalıdır (bkz. KONTRENDİKASYONLARI, UYARILAR, ve KLİNİK FARMAKOLOJİ: Farmakokinetik). Yaşlanma böbrek fonksiyonlarında azalma ile ilişkili olduğundan, yaş arttıkça Glukofaj veya Glukofaj XR dikkatle kullanılmalıdır. Doz seçiminde dikkatli olunmalı ve böbrek fonksiyonlarının dikkatli ve düzenli izlenmesine dayanmalıdır. Genel olarak, yaşlı hastalar maksimum Glukofaj veya Glükofaj XR dozuna titre edilmemelidir (ayrıca bkz. UYARILAR ve KULLANIM ŞEKLİ VE DOZU).
üst
Ters tepkiler
Tip 2 diyabetli hastalarda yapılan ABD çift kör Glucophage klinik çalışmasında, toplam 141 hastaya Glükofaj tedavisi (günde 2550 mg'a kadar) ve 145 hastaya plasebo verildi. Glukofaj hastalarının% 5'inden fazlasında rapor edilen ve Glukofajda plasebo ile tedavi edilen hastalardan daha yaygın görülen advers reaksiyonlar Tablo 11'de listelenmiştir.
Tablo 11: Glukofaj Monoterapisinde Plasebo Kontrollü Bir Klinik Çalışmada En Yaygın Olumsuz Reaksiyonlar (>% 5,0) *
| Olumsuz Reaksiyon | Glucophage monoterapi (N = 141) |
plasebo (N = 145) |
|---|---|---|
| Hastaların Yüzdesi | ||
| * Glukofajda plasebo ile tedavi edilen hastalardan daha sık görülen reaksiyonlar. | ||
| İshal | 53.2 | 11.7 |
| Bulantı kusma | 25.5 | 8.3 |
| tantana | 12.1 | 5.5 |
| asteni | 9.2 | 5.5 |
| Hazımsızlık | 7.1 | 4.1 |
| Karın Rahatsızlığı | 6.4 | 4.8 |
| Baş ağrısı | 5.7 | 4.8 |
Diyare, Glukofaj ile tedavi edilen hastaların% 6'sında çalışma ilacının kesilmesine neden oldu. Ek olarak, aşağıdaki advers reaksiyonlar Glucophage hastalarının â ‰ ¥% 1.0 ila â ‰ ¤5.0 aralığında bildirilmiştir ve Glucophage ile plasebodan daha yaygın olarak bildirilmiştir: anormal dışkı, hipoglisemi, kas ağrısı, baş dönmesi, nefes darlığı, tırnak bozukluğu, döküntü, terleme arttı, tat bozukluğu, göğüs rahatsızlığı, titreme, grip sendromu, kızarma, çarpıntı.
Dünya çapında yapılan klinik çalışmalarda, tip 2 diyabetli 900'den fazla hasta plasebo ve aktif kontrollü çalışmalarda Glucophage XR ile tedavi edilmiştir. Plasebo kontrollü çalışmalarda 781 hastaya Glucophage XR ve 195 hastaya plasebo verildi. Glucophage XR hastalarının% 5'inden fazlasında rapor edilen ve Glucophage XR-'de plasebo ile tedavi edilen hastalardan daha yaygın görülen advers reaksiyonlar Tablo 12'de listelenmiştir.
Tablo 12: Plasebo Kontrollü Glukofaj XR * Çalışmalarında En Yaygın Olumsuz Reaksiyonlar (>% 5,0)
| Olumsuz Reaksiyon | Glukofaj XR (N = 781) |
plasebo (N = 195) |
|---|---|---|
| Hastaların Yüzdesi | ||
| * Glucophage XR-'de plasebo ile tedavi edilen hastalardan daha sık görülen reaksiyonlar. | ||
| İshal | 9.6 | 2.6 |
| Bulantı kusma | 6.5 | 1.5 |
Diyare, Glukofaj XR ile tedavi edilen hastaların% 0.6'sında çalışma ilacının kesilmesine neden oldu. Ek olarak, aşağıdaki advers reaksiyonlar Glucophage XR hastalarının â ‰ ¥% 1.0 ila â ‰ ¤5.0 aralığında rapor edilmiş ve Glucophage XR ile daha yaygın olarak rapor edilmiştir plasebodan daha: karın ağrısı, kabızlık, karın şişliği, hazımsızlık / mide ekşimesi, şişkinlik, baş dönmesi, baş ağrısı, üst solunum yolu enfeksiyonu, tat rahatsızlık.
Pediyatrik hastalar
Tip 2 diyabetli pediatrik hastalarda Glukofaj ile yapılan klinik çalışmalarda, advers reaksiyonların profili yetişkinlerde gözlemlenenlere benzerdi.
üst
aşırı doz
50 gramdan daha büyük miktarların yutulması dahil olmak üzere aşırı dozda metformin hidroklorür meydana gelmiştir. Olguların yaklaşık% 10'unda hipoglisemi bildirilmiştir, ancak metformin hidroklorür ile nedensel bir ilişki saptanmamıştır. Metformin doz aşımı vakalarının yaklaşık% 32'sinde laktik asidoz bildirilmiştir (bkz. UYARILAR). Metformin, iyi hemodinamik koşullar altında 170 mL / dakikaya kadar açıklık ile diyaliz edilebilir. Bu nedenle, hemodiyaliz, metformin doz aşımından şüphelenilen hastalardan birikmiş ilacın uzaklaştırılması için yararlı olabilir.
üst
Dozaj ve Uygulama
Glucophage veya Glucophage XR veya başka herhangi bir farmakolojik ajan ile tip 2 diyabetli hastalarda hipergliseminin tedavisi için sabit bir dozaj rejimi yoktur. Glucophage veya Glucophage XR dozajı, önerilen maksimum günlük dozları aşmamakla birlikte, hem etkinlik hem de tolerans temelinde bireyselleştirilmelidir. Maksimum önerilen günlük Glükofaj dozu yetişkinlerde 2550 mg ve pediyatrik hastalarda (10-16 yaş) 2000 mg'dır; yetişkinlerde önerilen maksimum günlük Glucophage XR dozu 2000 mg'dır.
Glucophage öğünlerle bölünmüş dozlarda verilmeli, Glucophage XR genellikle akşam yemeği ile günde bir kez verilmelidir. Glucophage veya Glucophage XR düşük dozda, her ikisi de azaltmak için kademeli doz artışı ile başlatılmalıdır. gastrointestinal yan etkiler ve yeterli glisemik kontrol için gereken minimum dozun tanımlanmasına izin vermek hastanın.
Tedaviye başlama ve doz titrasyonu sırasında (aşağıdaki Tavsiye Edilen Doz Çizelgesi'ne bakın), açlık plazma glikozu Glucophage veya Glucophage XR'ye terapötik yanıtı belirlemek ve hasta. Daha sonra, glikosile hemoglobin yaklaşık 3 aylık aralıklarla ölçülmelidir. Terapötik amaç, hem açlık plazma glikozunu hem de glikosile hemoglobin seviyelerini normal veya normale yakın seviyeye düşürmek olmalıdır. monoterapi olarak kullanıldığında veya sülfonilüre ile kombinasyon halinde ya da sülfonilüre ile birlikte en düşük etkili Glucophage veya Glucophage XR dozunun kullanılması veya İnsülin.
Kan şekeri ve glikosile edilmiş hemoglobinin izlenmesi de birincil başarısızlığın, yani kan şekerinin önerilen maksimum ilaç dozu ve ikincil başarısızlık, yani, bir başlangıç periyodundan sonra yeterli bir kan şekeri düşürücü yanıtın kaybı etkinliği.
Glucophage veya Glucophage XR'nin kısa süreli uygulanması, genellikle sadece diyetle iyi kontrol edilen hastalarda geçici kontrol kaybı dönemlerinde yeterli olabilir.
Glukofaj XR tabletleri tamamen yutulmalı ve asla ezilmemeli veya çiğnenmemelidir. Bazen, Glukofaj XR'nin aktif olmayan bileşenleri dışkıda yumuşak, hidratlanmış bir kütle olarak elimine edilecektir.
Önerilen Doz Çizelgesi
Yetişkinler
Genel olarak, klinik olarak anlamlı yanıtlar günde 1500 mg'ın altındaki dozlarda görülmez. Bununla birlikte, gastrointestinal semptomları en aza indirmek için daha düşük bir başlangıç dozu ve kademeli olarak artan dozaj önerilmektedir.
Glukofaj (metformin hidroklorür) Tabletlerin olağan başlangıç dozu, günde iki kez 500 mg veya yemeklerle birlikte günde bir kez 850 mg'dır. Doz artışları, bölünmüş dozlarda verilen, günde toplam 2000 mg'a kadar, haftada 500 mg veya 2 haftada 850 mg'lık artışlarla yapılmalıdır. Hastalar ayrıca günde iki kez 500 mg'dan 2 hafta sonra günde iki kez 850 mg'a titre edilebilir. Ek glisemik kontrole ihtiyaç duyan hastalar için, günde maksimum 2550 mg'lık günlük doza Glükofaj verilebilir. 2000 mg'ın üzerindeki dozlar, günde 3 kez yemeklerle birlikte daha iyi tolere edilebilir.
Glukofaj XR (metformin hidroklorür) Uzatmalı Tabletlerin olağan başlangıç dozu, akşam yemeği ile günde bir kez 500 mg'dır. Doz artışları, akşam yemeği ile günde bir kez maksimum 2000 mg'a kadar haftalık 500 mg'lık artışlarla yapılmalıdır. Glucophage XR 2000 mg günde bir kez glisemik kontrol sağlanamazsa, günde iki kez Glucophage XR 1000 mg denenmesi düşünülmelidir. Daha yüksek metformin dozları gerekiyorsa, yukarıda tarif edildiği gibi bölünmüş günlük dozlarda uygulanan toplam 2550 mg'a kadar toplam günlük dozlarda Glukofaj kullanılmalıdır. (Görmek KLİNİK FARMAKOLOJİ: Klinik çalışmalar.)
Randomize bir çalışmada, şu anda Glükofaj ile tedavi edilen hastalar Glükofaj XR'ye değiştirildi. Bu çalışmanın sonuçları, Glükofaj tedavisi alan hastaların günde bir kez aynı toplam günlük dozda günde bir kez 2000 mg'a kadar Glucophage XR'ye güvenli bir şekilde geçebileceğini göstermektedir. Glucophage'dan Glucophage XR'ye geçişten sonra, glisemik kontrol yakından izlenmeli ve dozaj ayarlamaları buna göre yapılmalıdır (bkz. KLİNİK FARMAKOLOJİ: Klinik çalışmalar).
pediatri
Glukofajın normal başlangıç dozu, yemeklerle birlikte günde iki kez 500 mg'dır. Doz artışları, bölünmüş dozlar halinde, haftalık 500 mg ila günde en fazla 2000 mg'lık artışlarla yapılmalıdır. Pediatrik hastalarda Glucophage XR'nin güvenliği ve etkinliği belirlenmemiştir.
Diğer Antidiyabetik Terapiden Transfer
Klorpropamid dışındaki standart oral hipoglisemik ajanlardan Glucophage veya Glucophage XR'ye hasta aktarılırken, genellikle geçiş süresi gerekmez. Klorpropamid hastalarını transfer ederken, ilk 2 hafta boyunca dikkatli olunmalıdır. klorpropamidin vücutta uzun süre tutulması, üst üste binen ilaç etkilerine ve olası hipoglisemiye yol açar.
Yetişkin Hastalarda Eşlik Eden Glukofaj veya Glukofaj XR ve Oral Sülfonilüre Tedavisi
Hastalar maksimum Glukofaj veya Glucophage XR monoterapisine 4 hafta cevap vermediyse, yavaş yavaş ilavesine dikkat edilmelidir. bir sülfonilüre için birincil veya ikincil başarısızlık olsa bile, maksimum dozda Glucophage veya Glucophage XR'ye devam ederken oral bir sülfonilüre oluştu. Klinik ve farmakokinetik ilaç-ilaç etkileşim verileri şu anda sadece metformin artı gliburid (glibenklamid) için mevcuttur.
Eşlik eden Glukofaj veya Glükofaj XR ve sülfonilüre tedavisi ile, her bir ilacın dozunun ayarlanmasıyla kan glikozunun istenen kontrolü elde edilebilir. Tip 2 diyabetli hastalar ve daha önce gliburid başarısızlığı olan bir klinik çalışmada, 500 mg Glükofaj ve 20 mg gliburid kullanan hastalar 1000/20 mg olarak titre edildi, FPG, HbA1c ve plazma glikoz tepkisi ile ölçülen glisemik kontrol hedefine ulaşmak için sırasıyla 1500/20 mg, 2000/20 mg veya 2500/20 mg Glükofaj ve gliburit (görmek KLİNİK FARMAKOLOJİ: Klinik çalışmalar). Bununla birlikte, bu hedefe ulaşmak için her ilacın minimum etkili dozunu belirlemeye çalışılmalıdır. Eşlik eden Glukofaj veya Glukofaj XR ve sülfonilüre tedavisi ile sülfonilüre tedavisi ile ilişkili hipoglisemi riski devam eder ve artabilir. Uygun önlemler alınmalıdır. (İlgili sülfonilüre'nin prospektüsüne bakınız.)
Hastalar 1 ila 3 aylık eşzamanlı tedaviye maksimum Glukofaj veya Glukofaj XR dozu ve maksimum oral oral sülfonilüre dozu, Glucophage veya Glucophage XR ile veya Gresin olmadan insüline geçmeyi içeren terapötik alternatifleri düşünün.
Yetişkin Hastalarda Eşlik Eden Glukofaj veya Glukofaj XR ve İnsülin Tedavisi
Mevcut insülin dozu, Glucophage veya Glucophage XR tedavisi başladıktan sonra sürdürülmelidir. İnsülin tedavisi gören hastalarda, glükofaj veya Glükofaj XR tedavisi günde bir kez 500 mg'da başlatılmalıdır. Yeterli yanıt vermeyen hastalar için Glucophage veya Glucophage XR dozu 500 arttırılmalıdır. Yaklaşık 1 hafta sonra ve daha sonra yeterli glisemik kontrol sağlanana kadar her hafta 500 mg elde etti. Önerilen maksimum günlük doz, Glucophage için 2500 mg ve Glucophage XR için 2000 mg'dır. Plazma glukozunu açarken insülin dozunun% 10 ila% 25 azaltılması önerilir. eşzamanlı insülin ve Glukofaj alan hastalarda konsantrasyonlar 120 mg / dL'nin altına düşer veya Glukofaj XR. Daha fazla ayarlama, glikoz düşürücü yanıta göre kişiselleştirilmelidir.
Spesifik Hasta Popülasyonları
Glucophage veya Glucophage XR'nin hamilelikte kullanılması önerilmez. 10 yaşın altındaki hastalarda glukofaj önerilmez. Glukofaj XR, pediyatrik hastalarda (17 yaş altı) önerilmemektedir.
Glucophage veya Glucophage XR'nin başlangıç ve idame dozu, bu popülasyondaki böbrek fonksiyonlarında azalma potansiyeli nedeniyle ileri yaştaki hastalarda konservatif olmalıdır. Herhangi bir doz ayarlaması, böbrek fonksiyonunun dikkatli bir değerlendirmesine dayanmalıdır. Genel olarak, yaşlı, zayıflatılmış ve yetersiz beslenen hastalar, maksimum Glukofaj veya Glükofaj XR dozuna titre edilmemelidir.
Özellikle yaşlılarda laktik asidozun önlenmesine yardımcı olmak için böbrek fonksiyonunun izlenmesi gereklidir. (Görmek UYARILAR.)
üst
Nasıl tedarik edildi
Glucophage® (metformin hidroklorür) Tabletler
| 500 mg | 100 şişe | NDC 0087-6060-05 |
| 500 mg | 500 şişe | NDC 0087-6060-10 |
| 850 mg | 100 şişe | NDC 0087-6070-05 |
| 1000 mg | 100 şişe | NDC 0087-6071-11 |
Glukofaj 500 mg tabletler yuvarlak, beyaz ila kirli beyaz, film kaplı tabletler "BMS 6060 "bir tarafta tabletin çevresi ve" 500 "diğerinin yüzünde debossed yan.
Glükofaj 850 mg tabletler, "BMS ile debossed, yuvarlak, beyaz ila kirli beyaz, film kaplı tabletlerdir 6070 "tabletin bir tarafında çevre ve" 850 "diğer yüzünde debossed yan.
Glukofaj 1000 mg tabletler, beyaz, oval, bikonveks, bir tarafında "BMS 6071" ve diğer tarafında "1000" şeklinde debossed "BMS 6071" ile film kaplı tabletlerdir ve her iki tarafta da ikiye ayrılmış bir çizgidir.
Glucophage® XR (metformin hidroklorür) Uzatmalı Tabletler
| 500 mg | 100 şişe | NDC 0087-6063-13 |
| 750 mg | 100 şişe | NDC 0087-6064-13 |
Glukofaj XR 500 mg tabletler, beyazdan kirli beyaza, kapsül şeklinde, bikonveks tabletlerdir, bir tarafta "BMS 6063" ve diğer tarafın yüzünde "500" debossedir.
Glükofaj XR 750 mg tabletler kapsül şeklinde, bikonveks tabletlerdir, bir tarafta "BMS 6064" ve diğer tarafta "750" debossed. Tabletler açık kırmızıdır ve benekli bir görünüme sahip olabilir.
Depolama
20 ° -25 ° C (68 ° -77 ° F) sıcaklıkta saklayın; 15 ° -30 ° C'ye (59 ° -86 ° F) izin verilir. [Bkz. USP Kontrollü Oda Sıcaklığı.]
Işığa dayanıklı kaplarda dağıtın.
Glucophage®, Merck KGaA'nın Darmstadt, Almanya iştiraki olan Merck Santà S.S.S.'nin tescilli ticari markasıdır. Bristol-Myers Squibb Company'ye lisans verilmiştir.
Tarafından dağıtıldı:
Bristol-Myers Squibb Şirketi
Princeton, NJ 08543 ABD
son güncelleme: 01/2009
Glükofaj, metformin hidroklorür, hasta bilgisi (Sade ingilizce)
Diyabetin Belirtileri, Belirtileri, Nedenleri, Tedavileri Hakkında Detaylı Bilgi
Bu monograftaki bilgilerin olası tüm kullanımları, talimatları, önlemleri, ilaç etkileşimlerini veya yan etkileri kapsaması amaçlanmamıştır. Bu bilgiler genelleştirilmiştir ve özel tıbbi tavsiye olarak tasarlanmamıştır. Aldığınız ilaçlar hakkında sorularınız varsa veya daha fazla bilgi edinmek istiyorsanız, doktorunuza, eczacınıza veya hemşirenize danışın.
geri dön: Diyabet için tüm İlaçlara göz atın



