Diyabet Tedavisi için NovoLog
Marka Adı: NovoLog
Jenerik Adı: insülin aspart
Dozaj Formu: enjeksiyon
İçindekiler:
Göstergeler ve kullanımları
Dozaj ve Uygulama
Dozaj Formları ve Kuvvetleri
Kontrendikasyonlar
Uyarılar ve Önlemler
Ters tepkiler
İlaç etkileşimleri
Belirli Popülasyonlarda Kullanım
Doz Aşımı
Açıklama
Klinik Farmakoloji
Klinik Olmayan Toksikoloji
Klinik çalışmalar
Nasıl Sağlanır / Depolama ve Kullanım
NovoLog, insülin aspart, hasta bilgisi (Sade ingilizce)
Göstergeler ve kullanımları
Diyabetes mellitus tedavisi
NovoLog, yetişkinlerde ve diyabetes mellituslu çocuklarda glisemik kontrolü iyileştirmek için belirtilen bir insülin analogudur.
üst
Dozaj ve Uygulama
Dozlama
NovoLog, normal insan insülininden daha erken etki gösteren bir insülin analoğudur. NovoLog'un dozajı kişiselleştirilmelidir. Subkütan enjeksiyon ile verilen NovoLog genellikle orta veya uzun etkili insülin içeren rejimlerde kullanılmalıdır [bkz. Uyarılar ve Önlemler, Nasıl Sağlanır / Depolama ve Kullanım]. Toplam günlük insülin gereksinimi değişebilir ve genellikle 0,5 ila 1,0 birim / kg / gün arasındadır. Küspeye bağlı subkutan enjeksiyon tedavisi rejiminde kullanıldığında, toplam insülinin% 50 ila 70'i gereklilikler NovoLog tarafından sağlanabilir ve geri kalanı bir ara etkili veya uzun etkili insülin. NovoLog'un nispeten hızlı başlangıcı ve kısa glikoz düşürücü aktivitesi nedeniyle, bazı hastalar daha fazlasını gerektirebilir NovoLog kullanırken yemek öncesi hiperglisemiyi önlemek için bazal insülin ve daha fazla toplam insülin, normal insan kullanımından daha fazla İnsülin.
Viskoz (kalınlaşmış) veya bulutlu NovoLog kullanmayın; yalnızca berrak ve renksiz olduğunda kullanın. NovoLog yazdırılan son kullanma tarihinden sonra kullanılmamalıdır.
Derialtı enjeksyonu
NovoLog, karın bölgesinde, kalça, uyluk veya üst kolda deri altı enjeksiyon ile uygulanmalıdır. NovoLog, insan normal insülinden daha hızlı bir başlangıç ve daha kısa bir aktivite süresine sahip olduğundan, yemekten hemen önce (5-10 dakika içinde) enjekte edilmelidir. Lipodistrofi riskini azaltmak için enjeksiyon bölgeleri aynı bölge içinde döndürülmelidir. Tüm insülinlerde olduğu gibi, NovoLog'un etki süresi doza, enjeksiyon bölgesine, kan akışına, sıcaklığa ve fiziksel aktivite seviyesine göre değişecektir.
NovoLog, subkütan enjeksiyon için NovoLog için İnsülin Seyreltme Ortamı ile seyreltilebilir. Bir kısım NovoLog'u dokuz kısım seyreltici ile seyreltmek, NovoLog'un onda biri (U-10'a eşdeğer) konsantrasyon verecektir. Bir parça NovoLog'u bir parça seyrelticiye seyreltmek, NovoLog'un yarısı kadar bir konsantrasyon verecektir (U-50'ye eşdeğer).
Harici Pompa ile Sürekli Subkütan İnsülin İnfüzyonu (CSII)
NovoLog ayrıca harici bir insülin pompası ile deri altına infüze edilebilir [bkz. Uyarılar ve Önlemler, Nasıl Sağlanır / Depolama ve Kullanım]. Seyreltilmiş insülin harici insülin pompalarında kullanılmamalıdır. NovoLog, insan normal insülinden daha hızlı bir başlangıç ve daha kısa bir aktivite süresine sahip olduğundan, NovoLog'un yemek öncesi bolusları yemekten hemen önce (5-10 dakika içinde) infüze edilmelidir. İnfüzyon bölgeleri, lipodistrofi riskini azaltmak için aynı bölge içinde döndürülmelidir. Harici insülin infüzyon pompasının ilk programlaması, bir önceki rejimin toplam günlük insülin dozuna dayanmalıdır. Önemli bir değişken değişkenlik olmasına rağmen, toplam dozun yaklaşık% 50'si genellikle NovoLog'un yemekle ilgili bolusları olarak, geri kalanı ise bazal infüzyon olarak verilir. Haznedeki NovoLog'u, infüzyon setlerini ve infüzyon seti ekleme bölgesini en az 48 saatte bir değiştirin.
İntravenöz Kullanım
NovoLog, hipoglisemi ve hipokalemiden kaçınmak için kan şekeri ve potasyum düzeylerinin yakından izlenmesiyle glisemik kontrol için tıbbi gözetim altında intravenöz olarak uygulanabilir [bkz. Uyarılar ve Önlemler, Nasıl Sağlanır / Depolama ve Kullanım]. İntravenöz kullanım için polipropilen infüzyon torbaları kullanılan infüzyon sistemlerinde NovoLog, 0.05 U / mL ila 1.0 U / mL insülin aspart konsantrasyonlarında kullanılmalıdır. NovoLog'un% 0.9 sodyum klorür gibi infüzyon sıvılarında stabil olduğu gösterilmiştir.
Parenteral uygulamadan önce NovoLog'u partikül madde ve renk değişikliği açısından inceleyin.
üst
Dozaj Formları ve Kuvvetleri
NovoLog aşağıdaki paket boyutlarında mevcuttur: her sunum mL başına 100 birim insülin aspart içerir (U-100).
- 10 mL şişeler
- 3 mL PenFill kartuş dağıtım cihazı için 3 mL PenFill kartuşları (NovoPen® 3 PenMate® ilavesiyle veya eklenmeden) NovoFine® tek kullanımlık iğnelerle
- 3 mL NovoLog FlexPen Hazır Şırınga
üst
Kontrendikasyonlar
NovoLog kontrendikedir
- hipoglisemi atakları sırasında
- NovoLog veya yardımcı maddelerden birine aşırı duyarlılığı olan hastalarda.
üst
Uyarılar ve Önlemler
yönetim
NovoLog, normal insan insülininden daha hızlı bir etki başlamasına ve daha kısa bir faaliyet süresine sahiptir. NovoLog enjeksiyonunu hemen 5-10 dakika içinde bir yemek takip etmelidir. NovoLog'un kısa etki süresi nedeniyle, tip 1 diyabetli hastalarda daha uzun etkili bir insülin kullanılmalıdır ve tip 2 diyabetli hastalarda da gerekebilir. Tüm diyabetli hastalar için glikoz izleme önerilir ve harici pompa infüzyon tedavisi kullanan hastalar için özellikle önemlidir.
İnsülin dozundaki herhangi bir değişiklik dikkatli bir şekilde ve sadece tıbbi gözetim altında yapılmalıdır. Bir insülin ürününden diğerine geçmek veya insülin kuvvetini değiştirmek, dozajda bir değişikliğe ihtiyaç duyulmasına neden olabilir. Tüm insülin preparatlarında olduğu gibi, NovoLog hareketinin zaman süreci farklı bireylerde veya aynı anda farklı zamanlarda değişebilir Bireyseldir ve enjeksiyon bölgesi, lokal kan temini, sıcaklık ve fiziksel aktivite de dahil olmak üzere birçok koşula bağlıdır. Fiziksel aktivite veya yemek planını değiştiren hastalar, insülin dozajlarının ayarlanmasını gerektirebilir. İnsülin gereksinimleri hastalık, duygusal rahatsızlıklar veya diğer stresler sırasında değiştirilebilir.
Sürekli subkutan insülin infüzyon pompası tedavisi kullanan hastalar, insülini enjeksiyonla uygulamak için eğitilmeli ve pompa arızası durumunda alternatif insülin tedavisine sahip olmalıdır.
hipoglisemi
Hipoglisemi, NovoLog dahil olmak üzere tüm insülin tedavilerinin en yaygın yan etkisidir. Şiddetli hipoglisemi bilinç kaybına ve / veya konvülsiyonlara yol açabilir ve beyin fonksiyonunda veya ölümünde geçici veya kalıcı bozulmaya neden olabilir. Başka bir kişinin ve / veya parenteral glikoz infüzyonunun yardımını gerektiren şiddetli hipoglisemi veya insülin ile yapılan klinik çalışmalarda, NOVOLOG.
Hipogliseminin zamanlaması genellikle uygulanan insülin formülasyonlarının zaman-etki profilini yansıtır [bkz. Klinik Farmakoloji]. Gıda alımındaki değişiklikler (örneğin, gıda miktarı veya öğün zamanlaması), enjeksiyon yeri, egzersiz ve eşlik eden ilaçlar gibi diğer faktörler de hipoglisemi riskini değiştirebilir [bkz. İlaç etkileşimleri]. Tüm insülinlerde olduğu gibi, hipoglisemi farkındalığı olmayan hastalarda ve hipoglisemiye yatkın olabilen hastalarda (örn. Oruç tutan veya düzensiz gıda alımı olan hastalar) dikkatli olun. Hastanın konsantre olma ve reaksiyon gösterme yeteneği, hipogliseminin bir sonucu olarak bozulabilir. Bu, diğer makinelerin kullanılması veya kullanılması gibi bu yeteneklerin özellikle önemli olduğu durumlarda bir risk oluşturabilir.
Serum glikoz düzeylerindeki hızlı değişiklikler, glikoz değerinden bağımsız olarak diyabetli kişilerde hipoglisemi semptomlarına neden olabilir. Hipogliseminin erken uyarı semptomları, aşağıdaki gibi belirli koşullar altında farklı veya daha az belirgin olabilir uzun süredir devam eden diyabet, diyabetik sinir hastalığı, beta-blokerler veya yoğun diyabet gibi ilaçların kullanımı kontrol [bkz. İlaç etkileşimleri]. Bu durumlar hastanın hipoglisemi hakkında farkında olmadan önce ciddi hipoglisemi (ve muhtemelen bilinç kaybı) ile sonuçlanabilir. İntravenöz olarak uygulanan insülin, deri altı olarak uygulanan insüline göre daha hızlı bir etki başlangıcına sahiptir ve hipoglisemi için daha yakın izleme gerektirir.
hipokalemi
NovoLog dahil olmak üzere tüm insülin ürünleri, potasyumun hücre dışı alandan hücre içi boşluğa kaymasına neden olur, muhtemelen tedavi edilmezse solunum felci, ventriküler aritmi ve hiperpotasemiye yol açabilir. ölüm. Hipokalemi riski olan hastalarda dikkatli olun (örn., Potasyum düşürücü ilaçlar kullanan hastalar, hastalar serum potasyum konsantrasyonlarına duyarlı ilaçlar ve intravenöz olarak uygulanan hastalar almak insülin).
Böbrek yetmezliği
Diğer insülinlerde olduğu gibi, böbrek yetmezliği olan hastalarda NovoLog için doz gereksinimleri azaltılabilir [bkz. Klinik Farmakoloji].
Karaciğer yetmezliği
Diğer insülinlerde olduğu gibi, karaciğer yetmezliği olan hastalarda NovoLog için doz gereksinimleri azaltılabilir [bkz. Klinik Farmakoloji].
Aşırı Duyarlılık ve Alerjik Reaksiyonlar
Lokal Reaksiyonlar - Diğer insülin terapisinde olduğu gibi, hastalar NovoLog enjeksiyon yerinde kızarıklık, şişme veya kaşıntı yaşayabilir. Bu reaksiyonlar genellikle birkaç gün ila birkaç hafta arasında düzelir, ancak bazı durumlarda NovoLog'un kesilmesini gerektirebilir. Bazı durumlarda, bu reaksiyonlar, bir cilt temizleme maddesindeki tahriş edici maddeler veya zayıf enjeksiyon tekniği gibi insülin dışındaki faktörlerle ilişkili olabilir. NovoLog'da bir yardımcı madde olan enjekte edilen metakresol ile lokal reaksiyonlar ve genel miyalji bildirilmiştir.
Sistemik Reaksiyonlar - NovoLog dahil olmak üzere herhangi bir insülin ürünü ile anafilaksi dahil olmak üzere ciddi, hayatı tehdit eden, genelleşmiş alerji oluşabilir. Onay sonrasında NovoLog ile anafilaktik reaksiyonlar bildirilmiştir. İnsüline karşı genel alerji ayrıca tüm vücut döküntülerine (kaşıntı dahil), nefes darlığı, hırıltılı solunum, hipotansiyon, taşikardi veya terlemeye neden olabilir. Kontrollü klinik çalışmalarda, normal insan insülini ile tedavi edilen 735 hastanın 3'ünde (% 0.4) ve NovoLog ile tedavi edilen 1394 hastanın 10'unda (% 0.7) alerjik reaksiyonlar bildirilmiştir. Kontrollü ve kontrolsüz klinik çalışmalarda 2341'in 3'ü (% 0,1) NovoLog ile tedavi edilen hastaların alerjik reaksiyonlar nedeniyle tedaviyi bırakmaları.
Antikor Üretimi
NovoLog ile tedavi edilen hastalarda hem insan insülini hem de insülin aspart ile reaksiyona giren anti-insülin antikor titrelerinde artış gözlenmiştir. Anti-insülin antikorlarındaki artışlar, NovoLog ile normal insan insülininden daha sık görülür. Tip 1 diyabetli hastalarda 12 aylık kontrollü bir çalışmadan elde edilen veriler, bu antikorlardaki artışın geçici olduğunu ve farklılıkların olduğunu göstermektedir. 3 ila 6 ayda gözlenen normal insan insülini ve insülin aspart tedavi grupları arasındaki antikor seviyelerinde, 12. aydır. Bu antikorların klinik önemi bilinmemektedir. Bu antikorların glisemik kontrolde bozulmaya neden olduğu veya insülin dozunda artışa neden olduğu görülmemektedir.
İnsülinlerin Karışması
- Enjeksiyondan hemen önce NovoLog'un NPH insan insülini ile karıştırılması, pik konsantrasyonunu zayıflatır. NovoLog, zirve konsantrasyonu veya toplam biyoyararlanım süresini önemli ölçüde etkilemeden NOVOLOG. NovoLog NPH insan insülini ile karıştırılırsa, önce şırıngaya NovoLog çekilmeli ve karışım karıştırıldıktan hemen sonra enjekte edilmelidir.
- NovoLog'un diğer üreticiler tarafından üretilen insülin preparatlarıyla karıştırılmasının etkinliği ve güvenliği araştırılmamıştır.
- İnsülin karışımları intravenöz olarak uygulanmamalıdır.
Harici Pompa ile Sürekli Subkütan İnsülin İnfüzyonu
Harici bir subkütan insülin infüzyon pompasında kullanıldığında, NovoLog başka bir insülin veya seyreltici ile karıştırılmamalıdır. Harici bir insülin pompasında NovoLog kullanırken, NovoLog'a özgü bilgiler izlenmelidir (örn. Kullanım süresi, infüzyon setlerini değiştirme sıklığı) çünkü NovoLog'a özgü bilgiler genel pompa kılavuzundan farklı olabilir Talimatlar.
Pompa veya infüzyon seti arızaları veya insülin bozulması, insülinin küçük deri altı deposu nedeniyle hızlı bir hiperglisemi ve ketoza neden olabilir. Bu özellikle cilt yoluyla daha hızlı emilen ve daha kısa etki süresine sahip hızlı etkili insülin analogları için geçerlidir. Hiperglisemi veya ketozis nedeninin derhal tanımlanması ve düzeltilmesi gereklidir. Subkütan enjeksiyon ile ara tedavi gerekebilir [bkz. Dozaj ve Uygulama, Uyarılar ve Önlemler, ve Nasıl Sağlanır / Depolama ve Kullanım].
NovoLog'un, aşağıda listelenen insülin infüzyonuna uygun pompa sistemlerinde kullanılması önerilir.
pompaları:
MiniMed 500 serisi ve diğer eşdeğer pompalar.
Rezervuarlar ve infüzyon setleri:
NovoLog, insülin ve spesifik pompa ile uyumlu rezervuar ve infüzyon setlerinde kullanılması tavsiye edilir. In-vitro çalışmalar, NovoLog 48 saatten daha uzun bir süre pompa sisteminde tutulduğunda pompa arızası, metakresol kaybı ve insülin bozulması meydana gelebileceğini göstermiştir. Rezervuarlar ve infüzyon setleri en az 48 saatte bir değiştirilmelidir.
NovoLog 37 ° C'den (98,6 ° F) yüksek sıcaklıklara maruz bırakılmamalıdır. Bir pompada kullanılacak NovoLog diğer insülin veya seyreltici ile karıştırılmamalıdır [bkz. Dozaj ve Uygulama, Uyarılar ve Önlemler, ve Nasıl Sağlanır / Depolama ve Kullanım].
üst
Ters tepkiler
Klinik Araştırma Deneyimi
Klinik çalışmalar çok çeşitli tasarımlar altında gerçekleştirildiğinden, bir klinik çalışmada bildirilen advers reaksiyon oranları başka bir klinik çalışmada bildirilen oranlarla kolayca karşılaştırılabilir ve klinikte gerçekte gözlenen oranları yansıtmayabilir. uygulama.
- hipoglisemi
NovoLog dahil olmak üzere insülin kullanan hastalarda hipoglisemi en sık görülen advers reaksiyondur [bkz. Uyarılar ve Önlemler].
- İnsülin başlatma ve glikoz kontrolünün yoğunlaştırılması
Glikoz kontrolünde yoğunlaşma veya hızlı iyileşme geçici, geri dönüşümlü bir hastalık ile ilişkilendirilmiştir. oftalmolojik kırılma bozukluğu, diyabetik retinopatinin kötüleşmesi ve akut ağrılı periferik nöropati. Bununla birlikte, uzun süreli glisemik kontrol diyabetik retinopati ve nöropati riskini azaltır.
- lipodistrofi
NovoLog dahil olmak üzere uzun süreli insülin kullanımı, tekrarlanan insülin enjeksiyonları veya infüzyon yerinde lipodistrofiye neden olabilir. Lipodystrofi, lipohipertrofiyi (yağ dokusunun kalınlaşması) ve lipoatrofiyi (yağ dokusunun incelmesi) içerir ve insülin emilimini etkileyebilir. Lipodistrofi riskini azaltmak için insülin enjeksiyonunu veya infüzyon bölgelerini aynı bölgede döndürün.
- Kilo almak
Kilo alımı, NovoLog dahil olmak üzere bazı insülin tedavileri ile ortaya çıkabilir ve insülinin anabolik etkilerine ve glukozüri azalmasına bağlanmıştır.
- Periferik ödem
İnsülin, özellikle daha önce yoğunlaştırılmış insülin tedavisi ile zayıf metabolik kontrol geliştirilirse, sodyum tutulmasına ve ödemine neden olabilir.
- Olumsuz ilaç reaksiyonlarının sıklıkları
Tip 1 diabetes mellitus ve tip 2 diabetes mellituslu hastalarda NovoLog klinik çalışmaları sırasında advers ilaç reaksiyonlarının sıklıkları aşağıdaki tablolarda listelenmiştir.
Tablo 1: Tip 1 Diyabetes Mellituslu Hastalarda Tedaviye Bağlı Olumsuz Durumlar (Olumsuz olaylar) sıklığı â ‰ ¥% 5 ve insan normal insüline kıyasla NovoLog ile daha sık görülür listelenmiş)
|
NovoLog + NPH N = 596 |
İnsan Düzenli İnsülin + NPH N = 286 |
|||
| Tercih Edilen Terim | N- | (%) | N- | (%) |
| Hipoglisemi * | 448 | 75% | 205 | 72% |
| Baş ağrısı | 70 | 12% | 28 | 10% |
| Kaza sonucu yaralanma | 65 | 11% | 29 | 10% |
| Mide bulantısı | 43 | 7% | 13 | 5% |
| İshal | 28 | 5% | 9 | 3% |
* Hipoglisemi, kan şekeri konsantrasyonunun bir bölümü olarak tanımlanır
Tablo 2: Tip 2 Diyabetes Mellituslu Hastalarda Tedaviye Bağlı Olumsuz Yan Etkiler (hipoglisemi hariç, İnsan normal insülinine kıyasla NovoLog ile% â ¥ 5% sıklıkta ve daha sık görülen advers olaylar şunlardır: listelenmiş)
|
NovoLog + NPH N = 91 |
İnsan Düzenli İnsülin + NPH N = 91 |
|||
| N- | (%) | N- | (%) | |
| hipoglisemi * | 25 | 27% | 33 | 36% |
| hiporefleksi | 10 | 11% | 6 | 7% |
| Onikomikozu | 9 | 10% | 5 | 5% |
| Duyu rahatsızlığı | 8 | 9% | 6 | 7% |
| İdrar yolu enfeksiyonu | 7 | 8% | 6 | 7% |
| Göğüs ağrısı | 5 | 5% | 3 | 3% |
| Baş ağrısı | 5 | 5% | 3 | 3% |
| Cilt bozukluğu | 5 | 5% | 2 | 2% |
| Karın ağrısı | 5 | 5% | 1 | 1% |
| Sinüzit | 5 | 5% | 1 | 1% |
* Hipoglisemi, kan şekeri konsantrasyonunun bir bölümü olarak tanımlanır
Pazarlama Sonrası Veriler
NovoLog'un postoproval kullanımı sırasında aşağıdaki ek advers reaksiyonlar tanımlanmıştır. Bu advers reaksiyonlar, belirsiz büyüklükteki bir popülasyondan gönüllü olarak bildirildiğinden, frekanslarını güvenilir bir şekilde tahmin etmek genellikle mümkün değildir. Posta insidansı sırasında diğer insülinlerin NovoLog için yanlışlıkla değiştirildiği ilaç hataları tespit edilmiştir.
üst
İlaç etkileşimleri
Bazı maddeler glikoz metabolizmasını etkiler ve insülin dozu ayarlaması ve özellikle yakından izleme gerektirebilir.
- Aşağıdakiler kan şekerini düşürücü etkiyi ve hipoglisemiye yatkınlığı artırabilecek maddelerin örnekleridir: oral antidiyabetik ürünler, pramlintid, ACE inhibitörleri, disopiramid, fibratlar, fluoksetin, monoamin oksidaz (MAO) inhibitörleri, propoksifen, salisilatlar, somatostatin analogu (örn., oktreotid), sülfonamid antibiyotikler.
- Aşağıdakiler kan şekerini düşürücü etkiyi azaltabilecek maddelerin örnekleridir: kortikosteroidler, niasin, danazol, diüretikler, sempatomimetik ajanlar (ör. epinefrin, salbutamol, terbutalin), izoniazid, fenotiazin türevleri, somatropin, tiroid hormonları, östrojenler, progestojenler (örn. oral kontraseptiflerde), atipik antipsikotikler.
- Beta-blokerler, klonidin, lityum tuzları ve alkol, insülinin kan şekerini düşürücü etkisini güçlendirebilir veya zayıflatabilir.
- Pentamidin, bazen hiperglisemi ile takip edilebilen hipoglisemiye neden olabilir.
- Beta-blokerler, klonidin, guanetidin ve reserpin gibi sempatolitik ürünler alan hastalarda hipoglisemi belirtileri azaltılabilir veya olmayabilir.
üst
Belirli Popülasyonlarda Kullanım
Gebelik
Gebelik Kategorisi B. Tüm gebeliklerde, ilaca maruz kalmasına bakılmaksızın, doğum kusurları, kaybı veya diğer olumsuz sonuçların arka plan riski vardır. Bu arka plan riski, hiperglisemi ile komplike olan gebeliklerde artar ve iyi metabolik kontrol ile azaltılabilir. Diyabetli veya gestasyonel diyabet öyküsü olan hastaların gebe kalmadan önce ve hamilelik boyunca iyi metabolik kontrolü sürdürmesi önemlidir. İnsülin gereksinimleri birinci trimesterde azalabilir, genellikle ikinci ve üçüncü trimesterde artabilir ve doğumdan sonra hızla düşebilir. Bu hastalarda glikoz kontrolünün dikkatle izlenmesi şarttır. Bu nedenle, kadın hastalara doktorlarına NovoLog alırken olmaları veya gebe kalmaları durumunda söylemeleri tavsiye edilmelidir.
Açık etiketli, randomize bir çalışma, tip 1 diyabetli 322 gebede NovoLog'un (n = 157) normal insan insülinine (n = 165) göre güvenilirliğini ve etkinliğini karşılaştırdı. Kayıtlı hastaların üçte ikisi çalışmaya girdiklerinde zaten hamile kalmışlardır. Hastaların sadece üçte biri gebe kalmadan önce kayıt olduğundan, çalışma konjenital malformasyon riskini değerlendirmek için yeterince büyük değildi. Her iki grup da hamilelik sırasında ~% 6'lık bir ortalama HbA1c elde etti ve maternal hipoglisemi insidansında anlamlı bir fark yoktu.
Sıçan ve tavşanlarda NovoLog ve düzenli insan insülini ile subkütan üreme ve teratoloji çalışmaları yapılmıştır. Bu çalışmalarda çiftleşme öncesi, çiftleşme sırasında ve hamilelik boyunca dişi sıçanlara ve organogenez sırasında tavşanlara NovoLog verildi. NovoLog'un etkileri, deri altı düzenli insan insülininde gözlenenden farklı değildi. İnsan insülini gibi NovoLog, sıçanlarda 200 U / kg / gün dozunda (insan subkutanının yaklaşık 32 katı) implantasyon öncesi ve sonrası kayıplara ve viseral / iskelet anormalliklerine neden oldu U / vücut yüzey alanına bağlı olarak 1.0 U / kg / gün dozu) ve 10 U / kg / gün dozunda tavşanlarda (U / kg bazında insan subkütan dozunun 1.0 U / kg / gün yaklaşık üç katı) vücut yüzeyi alan). Etkiler muhtemelen yüksek dozlarda maternal hipoglisemiye sekonderdir. Sıçanlarda 50 U / kg / gün dozunda ve tavşanlarda 3 U / kg / gün dozunda anlamlı bir etki gözlenmemiştir. Bu dozlar, sıçanlar için insan deri altı dozunun 1.0 U / kg / gün'ünün 8 katıdır ve U / vücut yüzey alanına bağlı olarak tavşanların insan deri altı dozunun 1.0 U / kg / gün'e eşittir.
Emziren Anneler
İnsülin aspartın anne sütüne geçip geçmediği bilinmemektedir. NovoLog kullanımı emzirme ile uyumludur, ancak emziren diyabetli kadınlar insülin dozlarının ayarlanmasını gerektirebilir.
Pediyatrik Kullanım
NovoLog, çocuklarda deri altı günlük enjeksiyonlar ve harici insülin pompası ile deri altı sürekli infüzyon için kullanım için onaylanmıştır. Lütfen Bölüme bakınız KLİNİK ÇALIŞMALAR klinik çalışmaların özetleri için.
Geriyatrik Kullanım
3 kontrollü klinik çalışmada NovoLog ile tedavi edilen toplam hasta sayısının (n = 1.375)% 2.6'sı (n = 36) 65 yaş ve üzerindeydi. Bu hastaların yarısında tip 1 diyabet (18/1285), diğer yarısında tip 2 diyabet (18/90) vardı. İnsan insülinine kıyasla NovoLog'a HbA1c yanıtı, özellikle tip 2 diyabetli hastalarda yaşa göre farklılık göstermedi. Yaşlı hastalarda NovoLog'un güvenliği konusunda genç hastalara kıyasla sonuçlara izin vermek için 65 yaş ve üzerindeki daha büyük hasta popülasyonlarında ek çalışmalara ihtiyaç vardır. Yaşın NovoLog etkisinin başlangıcı üzerindeki etkisini değerlendirmek için farmakokinetik / farmakodinamik çalışmalar yapılmamıştır.
üst
Doz Aşımı
Aşırı insülin uygulaması hipoglisemiye ve özellikle intravenöz olarak verildiğinde hipokalemiye neden olabilir. Hafif hipoglisemi atakları genellikle oral glikoz ile tedavi edilebilir. İlaç dozajında, yemek düzenlerinde veya egzersizde ayarlamalar gerekebilir. Koma, nöbet veya nörolojik bozukluğu olan daha şiddetli ataklar kas içi / deri altı glukagon veya konsantre intravenöz glikoz ile tedavi edilebilir. Belirgin klinik iyileşmeden sonra hipoglisemi tekrarlayabileceğinden sürekli karbonhidrat alımı ve gözlemi gerekebilir. Hipokalemi uygun şekilde düzeltilmelidir.
üst
Açıklama
NovoLog (insülin aspart [rDNA kökenli] enjeksiyon), kan şekerini düşürmek için kullanılan hızlı etkili bir insan insülini benzeri. NovoLog, amino asit prolininin tek bir ikame edilmesi haricinde düzenli insan insülini ile homologdur. aspartik asit B28 pozisyonunda bulunur ve Saccharomyces cerevisiae (fırıncı) kullanılarak rekombinant DNA teknolojisi ile üretilir. Maya). İnsülin aspart ampirik formül C'ye sahiptir.256'H381N-65079S6 ve 5825.8 molekül ağırlığı.
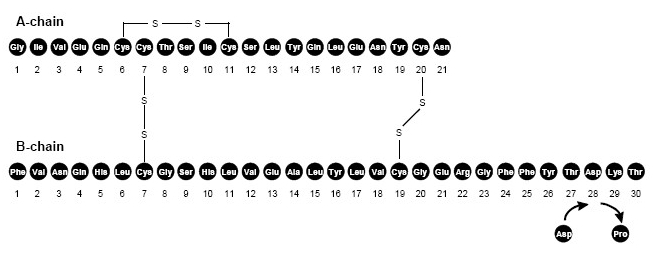
Şekil 1. İnsülin aspartın yapısal formülü.
NovoLog, insülin aspart 100 Birim / mL, gliserin 16 mg / mL, fenol içeren steril, sulu, berrak ve renksiz bir çözeltidir. 1.50 mg / mL, metakresol 1.72 mg / mL, çinko 19.6 mcg / mL, disodyum hidrojen fosfat dihidrat 1.25 mg / mL ve sodyum klorür 0.58 mg / ml. NovoLog'un pH değeri 7.2-7.6'dır. PH'ı ayarlamak için% 10 hidroklorik asit ve / veya% 10 sodyum hidroksit eklenebilir.
üst
Klinik Farmakoloji
Hareket mekanizması
NovoLog'un birincil aktivitesi glikoz metabolizmasının düzenlenmesidir. NovoLog dahil olmak üzere insülinler, kas ve yağ hücreleri üzerindeki insülin reseptörlerine bağlanır ve kan şekerini düşürür. hücrenin glikoz alımını kolaylaştırmak ve aynı anda glikoz çıkışını karaciğer.
Farmakodinamik
Normal gönüllülerde ve diyabetli hastalarda yapılan çalışmalar, subvotan NovoLog uygulamasının normal insan insülininden daha hızlı bir etki başlattığını göstermiştir.
Tip 1 diyabetli hastalarda (n = 22) yapılan bir çalışmada, NovoLog'un maksimum glikoz düşürücü etkisi, subkütan enjeksiyondan 1 ila 3 saat sonra ortaya çıktı (bkz. Şekil 2). NovoLog için eylem süresi 3 ila 5 saattir. İnsülin ve NovoLog gibi insülin analoglarının etki süresi farklı kişilerde veya aynı bireyde önemli ölçüde değişebilir. Şekil 2'de belirtildiği gibi NovoLog aktivitesinin parametreleri (başlangıç zamanı, pik zaman ve süre) sadece genel kurallar olarak düşünülmelidir. İnsülin emilimi ve aktivitenin başlangıcı, enjeksiyon, egzersiz ve diğer değişkenlerden etkilenir [bkz. Uyarılar ve Önlemler].
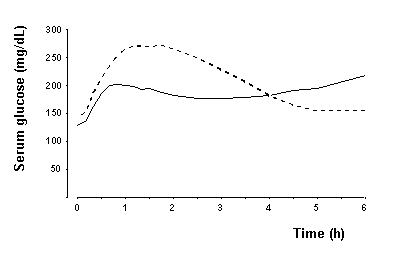
Şekil 2. Tek bir yemek öncesi NovoLog dozunu (katı eğri) takiben 6 saate kadar toplanan seri ortalama serum glikozu veya tip 1 olan 22 hastaya yemekten hemen önce enjekte edilen düzenli insan insülini (yumurtadan eğri) diyabet.
Tip 1 diyabetli 16 hastada çift kör, randomize, iki yönlü bir çapraz çalışma, intravenöz NovoLog infüzyonu, normal insanla intravenöz infüzyondan sonra benzer bir kan şekeri profili ile sonuçlandı. İnsülin. NovoLog veya insan insülini, hastanın kan şekeri 36 mg / dL'ye düşene veya hastaya kadar infüze edildi. otonom reaksiyon zamanı (R) olarak tanımlanan hipoglisemi belirtileri (kalp atış hızında ve terlemenin başlangıcı) gösterdi (bkz. Şekil 3).
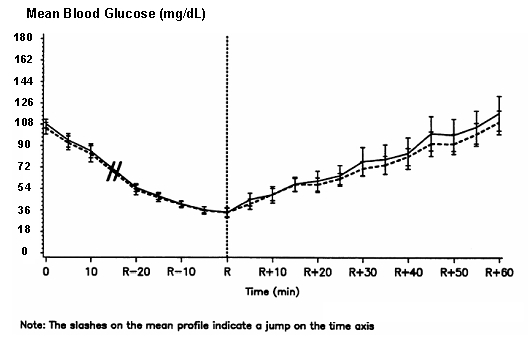
Figür 3. Tip 1 diyabetli 16 hastada intravenöz NovoLog (taranmış eğri) ve düzenli insan insülini (katı eğri) infüzyonunu takiben seri ortalama serum glikozu. R, otonom reaksiyon zamanını temsil eder.
Farmakokinetik
NovoLog'da amino asit prolin'in B28 pozisyonunda aspartik asit ile tek ikamesi, molekülün normal insan insülininde gözlendiği gibi heksamer oluşturma eğilimini azaltır. Bu nedenle NovoLog, normal insan insülinine kıyasla subkütan enjeksiyondan sonra daha hızlı emilir.
Randomize, çift-kör, çapraz çalışmada, 18 ila 40 yaşları arasında 17 sağlıklı Kafkas erkek denek yaş, 120 m için 1.5 mU / kg / dk'da NovoLog veya normal insan insülini intravenöz infüzyonu aldı dakika. Ortalama insülin klerensi, NovoLog grubu için ortalama 1.2 l / s / kg ve normal insan insülin grubu için 1.2 l / s / kg olan iki grup için benzerdi.
Biyoyararlanım ve Emilim - NovoLog daha hızlı emilim, daha hızlı etki başlangıcı ve deri altı enjeksiyondan sonra normal insan insülininden daha kısa etki süresi (bkz. Şekil 2 ve Şekil 4). Normal insan insülinine kıyasla NovoLog'un göreceli biyoyararlanımı, iki insülinin benzer ölçüde emildiğini gösterir.
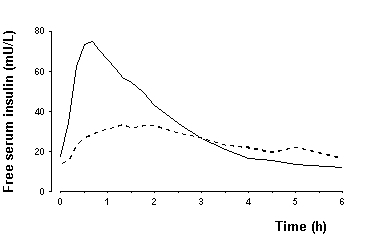
Şekil 4. Tek bir yemek öncesi NovoLog dozundan sonra 6 saate kadar toplanan seri ortalama serum içermeyen insülin konsantrasyonu Tip 1 olan 22 hastada yemekten hemen önce enjekte edilen (katı eğri) veya normal insan insülini (yumurtadan eğri) diyabet.
Sağlıklı gönüllülerde (toplam n = l07) ve tip 1 diyabetli hastalarda (toplam n = 40), NovoLog sürekli olarak normal insanın yaklaşık iki kat daha hızlı serum konsantrasyonlarına ulaştı İnsülin. Bu çalışmalarda maksimum konsantrasyona kadar geçen ortalama süre, NovoLog için 40 ila 50 dakika, normal insan insülini için 80 ila 120 dakika idi. Tip 1 diyabet, NovoLog ve düzenli insan insülini olan hastalarda yapılan klinik bir çalışmada, her ikisi de deri altından 0.15 U / kg vücut ağırlığı dozunda, ortalama maksimum 82 ve 36 mU / L konsantrasyonlarına ulaştı, sırasıyla. Tip 2 diyabetli hastalarda insülin aspartın farmakokinetik / farmakodinamik özellikleri belirlenmemiştir.
Sağlıklı erkek gönüllüler için maksimum serum insülin konsantrasyonuna kadar süre içinde bireyler arası değişkenlik, NovoLog için normal insan insülininden önemli ölçüde daha azdı. Bu gözlemin klinik önemi belirlenmemiştir.
Obez olmayan sağlıklı kişilerde yapılan bir klinik çalışmada, NovoLog ve düzenli arasındaki farmakokinetik farklılıklar yukarıda tarif edilen insan insülini, enjeksiyon bölgesinden (karın, uyluk veya üst) bağımsız olarak gözlenmiştir. kol).
Dağılım ve Eliminasyon - NovoLog, normal insan insülininde görülene benzer şekilde plazma proteinlerine (
Belirli Popülasyonlar
Çocuklar ve Ergenler - NovoLog ve düzenli insan insülininin farmakokinetik ve farmakodinamik özellikleri değerlendirildi 18 çocukta (6-12 yaş, n = 9) ve tip 1 ile ergenlerde (13-17 yaş [Tanner grade> 2], n = 9) tek dozluk bir çalışmada diyabet. Tip 1 diyabetli çocuk ve ergenlerde farmakokinetik ve farmakodinamiğin göreceli farklılıkları NovoLog ve normal insan insülini arasındaki sağlıklı yetişkin deneklere ve tip 1 erişkinlere benzerdi diyabet.
Cinsiyet - Sağlıklı gönüllülerde, vücut ağırlığı farklılıkları dikkate alındığında, erkekler ve kadınlar arasında insülin aspart düzeylerinde bir fark görülmemiştir. Tip 1 diyabetli hastalarda yapılan bir çalışmada cinsiyetler arasında (HbAlc tarafından değerlendirildiği gibi) kaydedilen etkinlik açısından anlamlı bir fark yoktu.
Obezite - Tip 1 diyabetli ve çok çeşitli vücut kitle indeksi (BMI, 22-39 kg / m2) olan 23 hastaya tek bir subkütan doz 0.1 U / kg NovoLog uygulanmıştır. NovoLog'un farmakokinetik parametreleri, AUC ve Cmax, farklı gruplarda BMI'den genellikle etkilenmedi - BMI 19-23 kg / m2 (N = 4); BMI 23-27 kg / m2 (N = 7); BMI 27-32 kg / m2 (N = 6) ve BMI> 32 kg / m2 (N = 6). BMI> 32 kg / m2 olan hastalarda NovoLog klerensi, VKİ'li hastalara göre% 28 azalmıştır
Böbrek yetmezliği - İnsan insülini ile yapılan bazı çalışmalar böbrek yetmezliği olan hastalarda dolaşımdaki insülin düzeylerinin arttığını göstermiştir. Bir çalışmada, normal (N = 6) kreatinin klerensi (CLcr) (> 80 ml / dakika) veya hafif (N = 7; CLcr = 50-80 ml / dakika), orta (N = 3; CLcr = 30-50 ml / dakika) veya şiddetli (ancak hemodiyaliz gerektirmeyen) (N = 2; CLcr = Uyarılar ve Önlemler].
Karaciğer Yetmezliği - İnsan insülini ile yapılan bazı çalışmalar, karaciğer yetmezliği olan hastalarda dolaşımdaki insülin seviyelerinin arttığını göstermiştir. Tek bir subkutan doz 0.06 U / kg NovoLog açık etiketli, 24 kişiden oluşan tek dozlu bir çalışmada (N = 6 / grup) farklı 0 (sağlıklı gönüllüler) ile 12 (şiddetli hepatik) arasında değişen Child-Pugh Skorlarına sahip karaciğer yetmezliği (hafif, orta ve şiddetli) derecesi bozukluğu). Bu küçük çalışmada, karaciğer yetmezliği derecesi ile herhangi bir NovoLog farmakokinetik parametresi arasında bir ilişki yoktu. Karaciğer fonksiyon bozukluğu olan hastalarda dikkatli glikoz izleme ve NovoLog dahil insülin doz ayarlamaları gerekebilir [bkz. Uyarılar ve Önlemler].
Yaş, etnik köken, gebelik ve sigaranın NovoLog'un farmakokinetiği ve farmakodinamiği üzerindeki etkisi araştırılmamıştır.
üst
Klinik Olmayan Toksikoloji
Karsinogenez, Mutajenez, Doğurganlık Bozukluğu
NovoLog'un kanserojen potansiyelini değerlendirmek için hayvanlarda standart 2 yıllık kanserojenlik çalışmaları yapılmamıştır. 52 haftalık çalışmalarda, Sprague-Dawley sıçanlarına 10, 50 ve 200 U / kg / gün NovoLog ile deri altından doz verildi. (U / vücut yüzey alanına bağlı olarak insan subkütan dozunun 1.0 U / kg / gün'ün yaklaşık 2, 8 ve 32 katı, sırasıyla). 200 U / kg / gün dozunda NovoLog, kadınlarda meme bezi tümörü insidansını tedavi edilmeyen kontrollere kıyasla arttırmıştır. NovoLog için meme tümörlerinin insidansı, normal insan insülininden anlamlı olarak farklı değildi. Bu bulguların insanlarla ilgisi bilinmemektedir. Aşağıdaki testlerde NovoLog genotoksik değildi: Ames testi, fare lenfoma hücresi ileri gen mutasyon testi, insan periferik kan lenfosit kromozom aberasyon testi, farelerde in vivo mikronükleus testi ve sıçan karaciğerinde ex vivo UDS testi hepatositler. Erkek ve dişi sıçanlarda doğurganlık çalışmalarında, 200 U / kg / gün'e kadar subkütan dozlarda (insan subkutan dozunun yaklaşık 32 katı, U / vücut yüzey alanına göre), erkek ve dişi doğurganlığı üzerinde doğrudan olumsuz etkiler veya hayvanların genel üreme performansı gözlemledi.
Hayvan Toksikolojisi ve / veya Farmakolojisi
Fare ve tavşanlardaki standart biyolojik analizlerde, bir birim NovoLog, bir birim normal insan insüliniyle aynı glikoz düşürücü etkiye sahiptir. İnsanlarda, NovoLog'un etkisi, deri altı enjeksiyondan sonra daha hızlı emilmesi nedeniyle, normal insan insülinine kıyasla başlangıçta ve daha kısa sürede daha hızlıdır (bkz. KLİNİK FARMAKOLOJİ Şekil 2 ve Şekil 4).
üst
Klinik çalışmalar
Deri altı Günlük Enjeksiyonlar
Tip 1 diyabetli yetişkin hastalarda NovoLog ile Novolin R'nin güvenilirliğini ve etkinliğini karşılaştırmak için altı aylık, açık etiketli, aktif kontrollü çalışmalar yapılmıştır. İki çalışma tasarımı ve sonuçları benzer olduğundan, veriler yalnızca bir çalışma için gösterilmiştir (bkz. Tablo 3). NovoLog, yemeklerden hemen önce deri altı enjeksiyon ile ve düzenli insan insülini yemeklerden 30 dakika önce deri altı enjeksiyon ile uygulandı. NPH insülini, tek veya bölünmüş günlük dozlarda bazal insülin olarak uygulandı. HbA1c'deki değişiklikler ve şiddetli hipogliseminin insidans oranları (üçte birinden müdahale gerektiren olayların sayısından belirlendiği gibi) taraf) bu çalışmada iki tedavi rejimi (Tablo 3) ve bu çalışmada belirtilen diğer klinik çalışmalarla karşılaştırılabilirdi Bölüm. Her iki tedavi grubundaki erişkin çalışmaların hiçbirinde diyabetik ketoasidoz bildirilmemiştir.
Tablo 3. Tip 1 Diyabette Subkütan NovoLog Uygulaması (24 hafta; n = 882)
| NovoLog + NPH | Novolin R + NPH | |
| N- | 596 | 286 |
| Temel HbA1c (%)* | 7.9 ±1.1 | 8.0 ± 1.2 |
| Baseline HbA'dan değişiklik1c (%) | -0.1 ± 0.8 | 0.0 ± 0.8 |
| HbA'da Tedavi Farkı1c, Ortalama (% 95 güven aralığı) | -0.2 (-0.3, -0.1) | |
| Başlangıç insülin dozu (IU / kg / 24 saat) * | 0.7 ± 0.2 | 0.7 ± 0.2 |
| Çalışma Sonu insülin dozu (IU / kg / 24 saat) * | 0.7 ± 0.2 | 0.7 ± 0.2 |
| Şiddetli hipoglisemi hastaları (n,%) - | 104 (17%) | 54 (19%) |
|
Temel vücut ağırlığı (kg) * Taban çizgisinden ağırlık değişimi (kg) * |
75.3 ± 14.5 0.5 ± 3.3 |
75.9 ± 13.1 0.9 ± 2.9 |
* Değerler Ortalama ± SS'dir
Şiddetli hipoglisemi, merkezi sinir sistemi semptomlarıyla ilişkili ve başka bir kişinin müdahalesini veya hastaneye yatmayı gerektiren hipoglisemiyi ifade eder.
6-18 yaş arası tip 1 diyabetli (n = 283) çocuk ve ergenlerde 24 haftalık, paralel grup çalışması iki subkütanöz çoklu doz tedavi rejimi ile karşılaştırıldığında yıllar: NovoLog (n = 187) veya Novolin R (n = 96). Bazal insülin olarak NPH insülini uygulandı. NovoLog, HbA1c'deki değişiklikle ölçüldüğü üzere Novolin R ile karşılaştırılabilir glisemik kontrol sağladı (Tablo 4) ve her iki tedavi grubu da benzer bir hipoglisemi insidansına sahipti. 2 ila 6 yaşları arasında tip 1 diyabetli (n = 26) HbA1c ve hipoglisemi üzerinde benzer etkileri olan NovoLog ve normal insan insülininin deri altı uygulaması da karşılaştırılmıştır.
Çizelge 4. Tip 1 Diyabette NovoLog'un Çocuklarda Subkütan Uygulaması (24 hafta; n = 283)
| NovoLog + NPH | Novolin R + NPH | |
| N- | 187 | 96 |
| Temel HbA1c (%) * | 8.3 ± 1.2 | 8.3 ± 1.3 |
| Baseline HbA'dan değişiklik1c (%) | 0.1 ± 1.0 | 0.1 ± 1.1 |
| HbA'da Tedavi Farkı1c, Ortalama (% 95 güven aralığı) | 0.1 (-0.5, 0.1) | |
| Başlangıç insülin dozu (IU / kg / 24 saat) * | 0.4 ± 0.2 | 0.6 ± 0.2 |
| Çalışma Sonu insülin dozu (IU / kg / 24 saat) * | 0.4 ± 0.2 | 0.7 ± 0.2 |
| Şiddetli hipoglisemi hastaları (n,%) - | 11 (6%) | 9 (9%) |
| Diyabetik ketoasidoz (n,%) | 10 (5%) | 2 (2%) |
|
Temel vücut ağırlığı (kg) * Taban çizgisinden ağırlık değişimi (kg) * |
50.6 ± 19.6 2.7 ± 3.5 |
48.7 ± 15.8 2.4 ± 2.6 |
* Değerler Ortalama ± SS'dir
Şiddetli hipoglisemi, merkezi sinir sistemi semptomlarıyla ilişkili ve başka bir kişinin müdahalesini veya hastaneye yatmayı gerektiren hipoglisemiyi ifade eder.
Tip 2 diyabetli hastalarda NovoLog ile Novolin R'nin güvenilirliğini ve etkinliğini karşılaştırmak için altı aylık, açık etiketli, aktif kontrollü bir çalışma yapılmıştır (Tablo 5). NovoLog, yemeklerden hemen önce deri altı enjeksiyon ile ve düzenli insan insülini yemeklerden 30 dakika önce deri altı enjeksiyon ile uygulandı. NPH insülini, tek veya bölünmüş günlük dozlarda bazal insülin olarak uygulandı. HbAlc'deki değişiklikler ve ciddi hipoglisemi oranları (üçüncü bir taraftan müdahale gerektiren olayların sayısından belirlendiği gibi) iki tedavi rejimi için karşılaştırılabilir olmuştur.
Çizelge 5. Tip 2 Diyabette Subkütan NovoLog Uygulaması (6 ay; n = 176)
| NovoLog + NPH | Novolin R + NPH | |
| N- | 90 | 86 |
| Temel HbA1c (%) * | 8.1 ± 1.2 | 7.8 ± 1.1 |
| Baseline HbA'dan değişiklik1c (%) | -0.3 ± 1.0 | -0.1 ± 0.8 |
| HbA'da Tedavi Farkı1c, Ortalama (% 95 güven aralığı) | - 0.1 (-0.4, -0.1) | |
| Başlangıç insülin dozu (IU / kg / 24 saat) * | 0.6 ± 0.3 | 0.6 ± 0.3 |
| Çalışma Sonu insülin dozu (IU / kg / 24 saat) * | 0.7 ± 0.3 | 0.7 ± 0.3 |
| Şiddetli hipoglisemi hastaları (n,%) - | 9 (10%) | 5 (8%) |
|
Temel vücut ağırlığı (kg) * Taban çizgisinden ağırlık değişimi (kg) * |
88.4 ± 13.3 1.2 ± 3.0 |
85.8 ± 14.8 0.4 ± 3.1 |
* Değerler Ortalama ± SS'dir
Şiddetli hipoglisemi, merkezi sinir sistemi semptomlarıyla ilişkili ve başka bir kişinin müdahalesini veya hastaneye yatmayı gerektiren hipoglisemiyi ifade eder.
Harici Pompa ile Sürekli Subkütan İnsülin İnfüzyonu (CSII)
İki açık etiketli, paralel tasarım çalışması (6 hafta [n = 29] ve 16 hafta [n = 118]) NovoLog'u tamponlu düzenli ile karşılaştırdı Harici bir insülin ile deri altı infüzyonu alan tip 1 diyabetli yetişkinlerde insan insülini (Velosulin) pompalamak. İki tedavi rejimi, HbA1c ve ciddi hipoglisemi oranlarında benzer değişikliklere sahipti.
Çizelge 6. Tip 1 Diyabette Yetişkin İnsülin Pompası Çalışması (16 hafta; n = 118)
| NOVOLOG | Tamponlanmış insan insülini | |
| N- | 59 | 59 |
| Temel HbA1c (%) * | 7.3 ± 0.7 | 7.5 ± 0.8 |
| Baseline HbA'dan değişiklik1c (%) | 0.0 ± 0.5 | 0.2 ± 0.6 |
| HbA'da Tedavi Farkı1c, Ortalama (% 95 güven aralığı) | 0.3 (-0.1, 0.4) | |
| Başlangıç insülin dozu (IU / kg / 24 saat) * | 0.7 ± 0.8 | 0.6 ± 0.2 |
| Çalışma Sonu insülin dozu (IU / kg / 24 saat) * | 0.7 ± 0.7 | 0.6 ± 0.2 |
| Şiddetli hipoglisemi hastaları (n,%) - | 1 (2%) | 2 (3%) |
|
Temel vücut ağırlığı (kg) * Taban çizgisinden ağırlık değişimi (kg) * |
77.4 ± 16.1 0.1 ± 3.5 |
74.8 ± 13.8 -0.0 ± 1.7 |
* Değerler Ortalama ± SS'dir
Şiddetli hipoglisemi, merkezi sinir sistemi semptomlarıyla ilişkili ve başka bir kişinin müdahalesini veya hastaneye yatmayı gerektiren hipoglisemiyi ifade eder.
4-18 yaş tip 1 diyabetli (n = 298) çocuk ve ergenlerin randomize, 16 haftalık, açık etiketli, paralel tasarım çalışması dış insülin pompası ile uygulanan iki deri altı infüzyon rejimi karşılaştırıldı: NovoLog (n = 198) veya insülin lispro (N = 100). Bu iki tedavi, 16 haftalık tedaviden sonra HbA1c'de taban çizgisinden karşılaştırılabilir değişiklikler ve karşılaştırılabilir hipoglisemi oranları ile sonuçlanmıştır (bakınız Tablo 7).
Çizelge 7. Tip 1 Diyabette Pediatrik İnsülin Pompası Çalışması (16 hafta; n = 298)
| NOVOLOG | Lispro'nun | |
| N- | 198 | 100 |
| Temel HbA1c (%) * | 8.0 ± 0.9 | 8.2 ± 0.8 |
| Baseline HbA'dan değişiklik1c (%) | -0.1 ± 0.8 | -0.1 ± 0.7 |
| HbA'da Tedavi Farkı1c, Ortalama (% 95 güven aralığı) | -0.1 (-0.3, 0.1) | |
| Başlangıç insülin dozu (IU / kg / 24 saat) * | 0.9 ± 0.3 | 0.9 ± 0.3 |
| Çalışma Sonu insülin dozu (IU / kg / 24 saat) * | 0.9 ± 0.2 | 0.9 ± 0.2 |
| Şiddetli hipoglisemi hastaları (n,%) - | 19 (10%) | 8 (8%) |
| Diyabetik ketoasidoz (n,%) | 1 (0.5%) | 0 (0) |
|
Temel vücut ağırlığı (kg) * Taban çizgisinden ağırlık değişimi (kg) * |
54.1 ± 19.7 1.8 ± 2.1 |
55.5 ± 19.0 1.6 ± 2.1 |
* Değerler Ortalama ± SS'dir
Şiddetli hipoglisemi, merkezi sinir sistemi semptomlarıyla ilişkili ve başka bir kişinin müdahalesini veya hastaneye yatmayı gerektiren hipoglisemiyi ifade eder.
Açık etiketli, 16 haftalık paralel tasarım denemesi, pre-prandial NovoLog enjeksiyonuyla birlikte karşılaştırıldı Tip 2 olan 127 yetişkinde sürekli subkütan infüzyonla uygulanan NovoLog'a NPH enjeksiyonları diyabet. İki tedavi grubu HbA1c ve şiddetli hipoglisemi oranlarında benzer düşüşlere sahipti (Tablo 8) [bkz. Göstergeler ve kullanımları, Dozaj ve Uygulama, Uyarılar ve Önlemler ve Nasıl Sağlanır / Depolama ve Kullanım].
Çizelge 8. Tip 2 Diyabette Pompa Tedavisi (16 hafta; n = 127)
| NovoLog pompası | NovoLog + NPH | |
| N- | 66 | 61 |
| Temel HbA1c (%) * | 8.2 ± 1.4 | 8.0 ± 1.1 |
| Baseline HbA'dan değişiklik1c (%) | -0.6 ± 1.1 | -0.5 ± 0.9 |
| HbA'da Tedavi Farkı1c, Ortalama (% 95 güven aralığı) | 0.1 (0.4, 0.3) | |
| Başlangıç insülin dozu (IU / kg / 24 saat) * | 0.7 ± 0.3 | 0.8 ± 0.5 |
| Çalışma Sonu insülin dozu (IU / kg / 24 saat) * | 0.9 ± 0.4 | 0.9 ± 0.5 |
|
Temel vücut ağırlığı (kg) * Taban çizgisinden ağırlık değişimi (kg) * |
96.4 ± 17.0 1.7 ± 3.7 |
96.9 ± 17.9 0.7 ± 4.1 |
* Değerler Ortalama ± SS'dir
NovoLog İntravenöz Yönetimi
Bkz.Bölüm Klinik Farmakoloji / Farmakodinamik.
üst
Nasıl Sağlanır / Depolama ve Kullanım
NovoLog aşağıdaki paket boyutlarında mevcuttur: her sunum mL başına 100 Ünite insülin aspart içerir (U-100).
| 10 mL şişeler | NDC 0169-7501-11 |
| 3 mL PenFill kartuşları * | NDC 0169-3303-12 |
| 3 mL NovoLog FlexPen Önceden doldurulmuş şırınga | NDC 0169-6339-10 |
* NovoLog PenFill kartuşları, Novo Nordisk 3 mL PenFill kartuşuyla uyumlu olarak kullanılmak üzere tasarlanmıştır NovoFine tek kullanımlık insülin verme cihazları (NovoPen 3 PenMate eklenmiş veya eklenmemiş) iğneler.
Önerilen Depolama Alanı
Kullanılmayan NovoLog buzdolabında 2 ° ile 8 ° C (36 ° - 46 ° F) arasında saklanmalıdır. Dondurucuda veya doğrudan buzdolabı soğutma elemanının yanında saklamayın. NovoLog'u dondurmayın ve dondurulmuşsa NovoLog'u kullanmayın. NovoLog bir şırınga içine çekilmemeli ve daha sonra kullanılmak üzere saklanmamalıdır.
Şişeler: İlk kullanımdan sonra bir şişe 28 güne kadar 30 ° C'nin (86 ° F) altındaki sıcaklıklarda tutulabilir, ancak aşırı sıcağa veya güneş ışığına maruz bırakılmamalıdır. Açılmış şişeler buzdolabında saklanabilir.
Delinmemiş şişeler, buzdolabında saklanırlarsa etikette yazılı olan son kullanma tarihine kadar kullanılabilir. Kullanılmayan şişeleri temiz tutun ve ışıktan koruyun.
PenFill kartuşları veya NovoLog FlexPen Önceden Doldurulmuş Şırıngalar:
Bir kartuş veya NovoLog FlexPen Önceden doldurulmuş bir şırınga delindikten sonra, 28 güne kadar 30 ° C'nin (86 ° F) altındaki sıcaklıklarda tutulmalıdır, ancak aşırı sıcağa veya güneş ışığına maruz bırakılmamalıdır. Kullanılan kartuşlar veya NovoLog FlexPen Önceden doldurulmuş şırıngalar buzdolabında saklanmamalıdır. Tüm PenFill® kartuşlarını ve tek kullanımlık NovoLog FlexPen Önceden doldurulmuş şırıngaları doğrudan ısı ve güneş ışığından uzak tutun. Delinmemiş PenFill kartuşları ve NovoLog FlexPen Önceden doldurulmuş şırıngalar, buzdolabında saklandıkları takdirde etikette yazılı olan son kullanma tarihine kadar kullanılabilir. Kullanılmayan PenFill kartuşlarını ve NovoLog FlexPen Önceden doldurulmuş şırıngaları temiz kalacak ve ışıktan koruyacak şekilde kartonda saklayın.
Her enjeksiyondan sonra iğneyi daima çıkarın ve 3 mL PenFill kartuş dağıtım cihazını veya NovoLog FlexPen Önceden doldurulmuş Şırıngayı iğne takılı olmadan saklayın. Bu, kontaminasyonu ve / veya enfeksiyonu veya insülin sızıntısını önler ve doğru dozlamayı sağlar. Kontaminasyonu önlemek için her enjeksiyon için daima yeni bir iğne kullanın.
Pompa:
Pompa haznesindeki NovoLog, en az 48 saatlik kullanımdan sonra veya 37 ° C (98,6 ° F) üzerindeki sıcaklıklara maruz kaldıktan sonra atılmalıdır.
Saklama Koşullarının Özeti:
Saklama koşulları aşağıdaki tabloda özetlenmiştir:
Tablo 9. Flakon, PenFill kartuşları ve NovoLog FlexPen Önceden doldurulmuş şırınga için saklama koşulları
|
NOVOLOG sunum |
Kullanılmıyor (açılmamış) Oda Sıcaklığı (30 ° C'nin altında) | Kullanılmıyor (açılmamış) | Kullanımda (açık) Oda Sıcaklığı (30 ° C'nin altında) |
| 10 mL şişe | 28 günler | Son kullanma tarihine kadar | 28 gün (soğutulmuş / oda sıcaklığı) |
| 3 mL PenFill kartuşları | 28 günler | Son kullanma tarihine kadar |
28 günler (Buzdolabında saklamayın) |
| 3 mL NovoLog FlexPen Önceden doldurulmuş şırınga | 28 günler | Son kullanma tarihine kadar |
28 günler (Buzdolabında saklamayın) |
Seyreltilmiş NovoLog'un saklanması
NovoLog için İnsülin Seyreltme Ortamı ile U-10'a eşdeğer veya U-50'ye eşdeğer bir konsantrasyona kadar seyreltilmiş NovoLog, hasta kullanımında 28 gün boyunca 30 ° C'nin (86 ° F) altındaki sıcaklıklarda kalabilir.
NovoLog'un İnfüzyon Sıvılarında Depolanması
Dozaj ve Uygulama (2) 'de belirtildiği gibi hazırlanan infüzyon torbaları, oda sıcaklığında 24 saat stabildir. Bazı insülin başlangıçta infüzyon torbasının malzemesine adsorbe edilecektir.
son güncelleme 12/2008
NovoLog, insülin aspart, hasta bilgisi (Sade ingilizce)
Diyabetin Belirtileri, Belirtileri, Nedenleri, Tedavileri Hakkında Detaylı Bilgi
Bu monograftaki bilgilerin olası tüm kullanımları, talimatları, önlemleri, ilaç etkileşimlerini veya yan etkileri kapsaması amaçlanmamıştır. Bu bilgiler genelleştirilmiştir ve özel tıbbi tavsiye olarak tasarlanmamıştır. Aldığınız ilaçlar hakkında sorularınız varsa veya daha fazla bilgi istiyorsanız, doktorunuza, eczacınıza veya hemşirenize danışın.
geri dön: Diyabet için tüm İlaçlara göz atın



