Diyabet Tedavisi için Byetta
Marka Adı: Byetta
Jenerik Adı: Exenatide
Dozaj Formu: Enjeksiyon
İçindekiler:
Açıklama
Klinik Farmakoloji
Klinik çalışmalar
Göstergeler ve kullanımları
Kontrendikasyonlar
Önlemler
Ters tepkiler
Doz Aşımı
Dozaj ve Uygulama
Depolama
Nasıl tedarik edildi
Byetta (Exenatide) Hasta Bilgisi (Sade ingilizce)
Açıklama
Byetta® (eksenatid), inkretin-mimetik etkilere sahip olan ve başlangıçta kertenkele Heloderma suspectum'da tanımlanan sentetik bir peptiddir. Byetta, pankreas beta hücresi tarafından glikoza bağımlı insülin sekresyonunu arttırır, uygun olmayan şekilde yükselen glukagon sekresyonunu baskılar ve mide boşalmasını yavaşlatır. Exenatide, kimyasal yapı ve insülin, sülfonilürelerden (farmakolojik etkilerden) farmakolojik etki bakımından farklılık gösterir. D-fenilalanin türevleri ve meglitinidler), biguanidler, tiazolidindionlar ve alfa-glukosidaz inhibitörleridir.
Eksenatid, 39âamino asit peptid amiddir. Exenatide ampirik formül C184'H282N-50Ö60S ve 4186.6 Dalton moleküler ağırlığı. Eksenatid için amino asit dizisi aşağıda gösterilmiştir.
H - His - Gly - Glu - Gly - Thr - Phe - Thr - Ser - Asp - Leu - Ser - Lys - Gln - Met - Glu - Glu - Glu - Ala - Val - Arg - Leu - Phe - Ile - Glu - Trp - Leu - Lys - Asn - Gly - Gly - Pro - Ser - Ser - Gly - Ala - Pro - Pro - Pro - Pro - Ser - NH2
Byetta, bir pen-enjektör (kalem) içine monte edilmiş bir cam kartuşta steril, korunmuş bir izotonik çözelti olarak subkütan (SC) enjeksiyon için tedarik edilir. Her mililitre (mL) 250 mikrogram (mcg) sentetik exenatid, antimikrobiyal koruyucu olarak 2.2 mg metakresol, tonisite ayarlama maddesi olarak mannitol ve pH 4.5'te tamponlama çözeltisi olarak enjeksiyon için suda glasiye asetik asit ve sodyum asetat trihidrat. 5 mcg'lik birim dozları vermek için iki adet önceden doldurulmuş kalem mevcuttur. 10 mcg. Önceden doldurulmuş her kalem, günde iki kez 30 günlük uygulama (BID) sağlamak için 60 doz verecektir.
üst
Klinik Farmakoloji
Hareket mekanizması
Glukagon benzeri peptit-1 (GLP-1) gibi inkretinler, glukoza bağımlı insülin sekresyonunu arttırır ve bağırsaktan dolaşım içine salındıktan sonra diğer antihiperglisemik eylemler sergiler. Eksenatid, glukoza bağımlı insülin sekresyonunun ve inkretinlerin diğer birkaç antihiperglisemik etkisinin artmasını taklit eden bir inkretin mimetik ajandır.
Eksenatidin amino asit dizisi, insan GLP-1'inin amino asit dizisiyle kısmen örtüşmektedir. Eksenatidin bilinen insan GLP-1 reseptörünü in vitro bağladığı ve aktive ettiği gösterilmiştir. Bu, hem insülinin glikoza bağımlı sentezinde hem de insülinin in vivo sekresyonunda bir artışa yol açar siklik AMP ve / veya diğer hücre içi sinyalleri içeren mekanizmalarla pankreas beta hücrelerinden yollar. Exenatide, yüksek glikoz konsantrasyonları varlığında beta hücrelerinden insülin salınımını arttırır. İn vivo uygulandığında, eksenatid GLP-1'in bazı antihiperglisemik etkilerini taklit eder.
Byetta, tip 2 diyabetli hastalarda açlık ve postprandiyal glikoz konsantrasyonlarını aşağıda açıklanan eylemlerle azaltarak glisemik kontrolü geliştirir.
Glikoza bağımlı insülin sekresyonu: Byetta'nın, glikoza pankreatik beta hücre duyarlılığı üzerinde akut etkileri vardır ve insülin salınımının sadece yüksek glikoz konsantrasyonları varlığında ortaya çıkmasına neden olur. Bu insülin sekresyonu kan şekeri konsantrasyonları azaldıkça ve öglisemiye yaklaştıkça azalır.
Birinci faz insülin cevabı: Sağlıklı bireylerde, intravenöz (IV) glikoz uygulamasından sonraki ilk 10 dakika boyunca sağlam insülin sekresyonu meydana gelir. "Birinci faz insülin yanıtı" olarak bilinen bu salgı, tip 2 diyabetli hastalarda karakteristik olarak yoktur. Birinci faz insülin cevabının kaybı, tip 2 diyabette erken beta hücre defekti. Byetta'nın terapötik plazma konsantrasyonlarında uygulanması, tip 2 diyabetli hastalarda IV bolus glikozuna birinci faz insülin yanıtını geri yükledi (Şekil 1). Hem birinci faz insülin sekresyonu hem de ikinci faz insülin sekresyonu, Byetta ile tedavi edilen tip 2 diyabetli hastalarda salin (p

Şekil 1: Tip 2 Diyabetli Hastalarda Byetta veya Salin İnfüzyonu Sırasında ve Sağlıklı Olgularda Salin İnfüzyonu Sırasında Ortalama (+ SEM) İnsülin Salgılama Oranı
Glukagon sekresyonu: Tip 2 diyabetli hastalarda Byetta, glukagon sekresyonunu hafifletir ve hiperglisemi dönemlerinde serum glukagon konsantrasyonlarını azaltır. Düşük glukagon konsantrasyonları hepatik glikoz üretiminin azalmasına ve insülin talebinin azalmasına yol açar. Bununla birlikte, Byetta hipoglisemiye normal glukagon tepkisini bozmaz.
Gastrik boşalma: Byetta gastrik boşalmayı yavaşlatır, böylece yemek kaynaklı glikozun dolaşımda görülme oranını azaltır.
Gıda alımı: Hem hayvanlarda hem de insanlarda, eksenatid uygulamasının gıda alımını azalttığı gösterilmiştir.
Farmakokinetik
emme
Tip 2 diyabetli hastalara SC uygulamasını takiben, eksenatid 2.1 saat içinde median pik plazma konsantrasyonlarına ulaşır. Ortalama pik eksenatid konsantrasyonu (Cmaksimum), 211 pg / mL idi ve eğrinin altındaki toplam ortalama alan (AUC0-inf), 10 mcg'lik bir Byetta dozunun SC uygulamasını takiben 1036 pg-h / mL idi. Exenatide maruz kalma (EAA), 5 mcg ila 10 mcg terapötik doz aralığında orantılı olarak artmıştır. Cmax değerleri aynı aralıkta orantılı olarak daha az arttı. Karın, uyluk veya kolda Byetta'nın SC uygulamasıyla benzer maruziyet elde edilir.
dağıtım
Tek bir Byetta dozunun SC uygulamasını takiben eksenatidin ortalama dağılım hacmi 28.3 L'dir.
Metabolizma ve Eliminasyon
Klinik olmayan çalışmalar, eksenatidin, daha sonra proteolitik degradasyon ile glomerüler filtrasyon ile baskın olarak elimine edildiğini göstermiştir. İnsanlarda görülen görünür eksenatidin klerensi 9.1 L / s'dir ve ortalama terminal yarı ömrü 2.4 saattir. Eksenatidin bu farmakokinetik özellikleri dozdan bağımsızdır. Çoğu insanda, eksenatid konsantrasyonları dozdan yaklaşık 10 saat sonra ölçülebilir.
Özel Nüfuslar
Böbrek yetmezliği
Hafif ila orta derecede böbrek yetmezliği olan hastalarda (kreatinin klerensi 30 ila 80 mL / dak), eksenatid klerensi sadece hafifçe azaldı; bu nedenle, hafif ila orta derecede böbrek yetmezliği olan hastalarda Byetta'nın doz ayarlamasına gerek yoktur. Bununla birlikte, diyaliz alan son dönem böbrek yetmezliği olan hastalarda, ortalama eksenatid klerensi sağlıklı kişilerde 9.1 L / s ile karşılaştırıldığında 0.9 L / s'ye düşürülür (bkz. ÖNLEMLER, Genel).
Karaciğer Yetmezliği
Akut veya kronik karaciğer yetmezliği tanısı olan hastalarda herhangi bir farmakokinetik çalışma yapılmamıştır. Eksenatid öncelikle böbrek tarafından temizlendiğinden, hepatik disfonksiyonun kan exenatide konsantrasyonlarını etkilemesi beklenmez (bkz. Farmakokinetik, Metabolizma ve Eliminasyon).
yaşlı
Hastaların popülasyon farmakokinetik analizi (22 ila 73 yıl arasında), yaşın eksenatidin farmakokinetik özelliklerini etkilemediğini göstermektedir.
pediatrik
Exenatide pediyatrik hastalarda çalışılmamıştır.
Cinsiyet
Erkek ve kadın hastaların popülasyon farmakokinetik analizi, cinsiyetin eksenatidin dağılımını ve eliminasyonunu etkilemediğini göstermektedir.
Yarış
Kafkas, Hispanik ve Siyah dahil hastaların popülasyon farmakokinetik analizi, ırkın eksenatidin farmakokinetiği üzerinde önemli bir etkisi olmadığını düşündürmektedir.
şişmanlık
Obezlerin (BMI - 30 kg / m2) ve obez olmayan hastaların popülasyon farmakokinetik analizi, obezitenin eksenatidin farmakokinetiği üzerinde anlamlı bir etkisi olmadığını düşündürmektedir.
İlaç etkileşimleri
Digoksin
Tekrarlanan Byetta dozlarının (10 mcg BID) birlikte uygulanması, C'yi azalttımaksimum oral digoksin (0.25 mg QD)% 17 oranında arttırıldı ve Tmax'ı yaklaşık 2.5 saat geciktirdi; bununla birlikte, genel kararlı durum farmakokinetik maruziyeti (EAA) değişmemiştir.
Lovastatin
Lovastatin EAA ve Cmax sırasıyla yaklaşık% 40 ve% 28 azaldı ve Bymax, Tetta yaklaşık 4 saat gecikti (10 mcg BID) uygulanan lovastatin ile karşılaştırıldığında tek bir doz lovastatin (40 mg) ile birlikte uygulandı tek başına. Byetta'nın 30 haftalık kontrollü klinik çalışmalarında, zaten HMG alan hastalarda Byetta kullanımı CoA redüktaz inhibitörleri, lipid profillerindeki tutarlı değişikliklerle ilişkili değildi bazal.
Lisinopril
Lisinopril (5 ila 20 mg / gün) üzerinde stabilize hafif ila orta derecede hipertansiyonu olan hastalarda, Byetta (10 mcg BID) kararlı durum Cmax veya lisinoprilin EAA'sını değiştirmedi. Lisinopril kararlı durum Tmaksimum 2 saat geciktirildi. Ortalama 24 saatlik sistolik ve diyastolik kan basıncında değişiklik olmadı.
asetaminofen
10 mcg Byetta (0 saat) ve Byet enjeksiyonundan 1 saat, 2 saat ve 4 saat sonra 1000 mg asetaminofen iksiri verildiğinde, asetaminofen EAA'lar sırasıyla% 21,% 23,% 24 ve% 14 azaldı; Cmaksimum sırasıyla% 37,% 56,% 54 ve% 41 azaldı; Tmaksimum kontrol periyodunda 0.6 saat iken, sırasıyla 0.9 saat, 4.2 saat, 3.3 saat ve 1.6 saat olmuştur. Asetaminofen AUC, Cmaksimum ve asetaminofen Byetta enjeksiyonundan 1 saat önce verildiğinde Tmax önemli ölçüde değişmedi.
Warfarin
Sağlıklı gönüllülerde tekrarlanan Byetta dozlarının (1-2 günlerde 5 mcg BID ve 3-9. Günlerde 10 mcg BID) birlikte uygulanması, varfarini (25 mg) Tmax'ı yaklaşık 2 saat geciktirmiştir. Varfarinin S- ve R-enantiomerlerinin Cmax veya AUC üzerinde klinik olarak anlamlı bir etkisi gözlenmemiştir. Byetta, varfarinin farmakodinamik özelliklerini (INR cevabı ile değerlendirildiği gibi) değiştirmedi.
Farmakodinamik
Postprandiyal Glikoz
Tip 2 diyabetli hastalarda, Byetta postprandiyal plazma glikoz konsantrasyonlarını azaltır (Şekil 2).
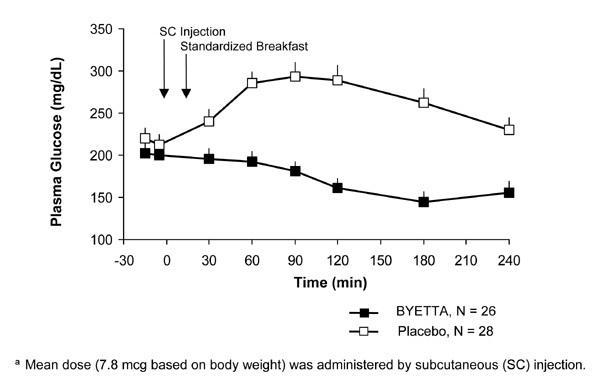
şekil 2: Byetta 1. Gününde Postprandiyal Plazma Glukoz Konsantrasyonlarının Ortalama (+ SEM)bir Metformin, Sülfonilüre veya Her İkisi İle Tedavi Edilen Tip 2 Diyabetli Hastalarda Tedavi (N = 54)
Oruç Glikoz
Tip 2 diyabet ve açlık hiperglisemisi olan hastalarda yapılan tek dozluk bir çapraz çalışmada, derhal bir insülin salınımı Byetta enjeksiyonunu izlemiştir. Plazma glukoz konsantrasyonları, plaseboya kıyasla Byetta ile önemli ölçüde azalmıştır (Şekil 3).
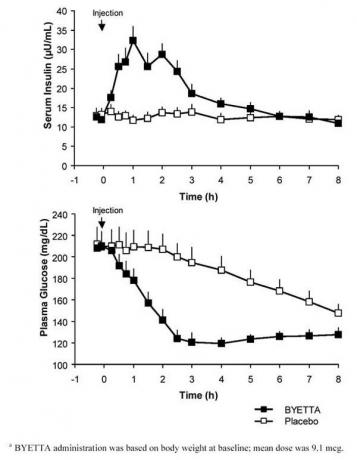
Şekil 3: Bir Kez Byetta Enjeksiyonu Sonrasında Ortalama (+ SEM) Serum İnsülin ve Plazma Glukoz Konsantrasyonlarıbir 2 Diyabetli Oruçlu Hastalarda Plasebo veya Plasebo (N = 12)
üst
Klinik çalışmalar
Metformin ve / veya bir sülfonilüre ile kullanım
Tip 30'lu hastalarda Byetta'nın güvenilirliğini ve etkinliğini değerlendirmek için 30 haftalık üç çift kör, plasebo kontrollü çalışma yapılmıştır. Glisemik kontrolü tek başına metformin, tek başına bir sülfonilüre veya bir ile birlikte metformin ile yetersiz olan 2 diyabet sülfonilüre.
Bu üç çalışmada toplam 1446 hasta randomize edilmiştir: 991 (% 68.5) Kafkas, 224 (% 15.5) İspanyol ve 174 (% 12.0) Siyahtır. Denemeler için başlangıçtaki ortalama HbA1c değerleri% 8.2 ile% 8.7 arasında değişmektedir. 4 haftalık plasebo giriş periyodundan sonra hastalar rastgele Byetta 5 mcg BID, Byetta 10 almak üzere atandı mcg BID veya sabah ve akşam yemeklerinden önce plasebo BID, mevcut oral antidiyabetiklerine ek olarak ajan. Byetta'ya atanan tüm hastalar 4 hafta boyunca 5 mcg BID ile tedaviye başlama periyoduna başladı. 4 hafta sonra, bu hastalar ya Byetta 5 mcg BID almaya devam ettiler veya dozları 10 mcg BID'ye yükseltildi. Plaseboya atanan hastalara çalışma boyunca plasebo BID'si verildi.
Her çalışmada birincil son nokta, başlangıç HbA'sından ortalama değişiklikti1c 30 haftada. Otuz haftalık çalışma sonuçları Tablo 1'de özetlenmiştir.
Tablo 1: Metformin, Sülfonilüre veya Her İkisinin Kullanımına Rağmen Yetersiz Glikoz Kontrollü Hastalarda Otuz Hafta Plasebo Kontrollü Byetta Denemelerinin Sonuçları
| plasebo TEKLİF |
Byetta 5 mcg Teklif |
Byetta 10 mcg* TEKLİF |
|
|---|---|---|---|
| |||
| Metformin ile Birlikte | |||
| Tedavi Etme Nüfusu (N) | 113 | 110 | 113 |
| HbA1c (%), Anlamına gelmek | |||
| Temel | 8.2 | 8.3 | 8.2 |
| 30. Haftadaki Değişim | +0.1 | −0.4†| −0.8c |
| HbA'ya Ulaşan Oran1c≤7% § | 13.0% | 31.6%†| 46.4%†|
| Vücut Ağırlığı (kg), Ortalama | |||
| Temel | 99.9 | 100.0 | 100.9 |
| 30. Haftadaki Değişim | −0.3 | −1.6†| −2.8c |
| Bir Sülfonilüre ile Birlikte | |||
| Tedavi Etme Nüfusu (N) | 123 | 125 | 129 |
| HbA1c (%), Anlamına gelmek | |||
| Temel | 8.7 | 8.5 | 8.6 |
| 30. Haftadaki Değişim | +0.1 | −0.5†| −0.9c |
| HbA'ya Ulaşan Oran1c≤7% § | 8.8% | 32.6%†| 41.3%c |
| Vücut Ağırlığı (kg), Ortalama | |||
| Temel | 99.1 | 94.9 | 95.2 |
| 30. Haftadaki Değişim | −0.6 | −0.9 | −1.6†|
| Metformin ve Sülfonilüre ile Birlikte | |||
| Tedavi Etme Nüfusu (N) | 247 | 245 | 241 |
| HbA1c (%), Anlamına gelmek | |||
| Temel | 8.5 | 8.5 | 8.5 |
| 30. Haftadaki Değişim | +0.2 | −0.6c | −0.8c |
| HbA'ya Ulaşan Oran1c≤7% § | 9.2% | 27.4%c | 33.5%c |
| Vücut Ağırlığı (kg), Ortalama | |||
| Temel | 99.1 | 96.9 | 98.4 |
| 30. Haftadaki Değişim | −0.9 | −1.6†| −1.6†|
HbA1c
Bir metformin, bir sülfonilüre veya her ikisine de Byetta eklenmesi, bazal HbA'dan istatistiksel olarak önemli azalmalar ile sonuçlandı.1c Üç kontrollü çalışmada bu ajanlara plasebo alan hastalarla karşılaştırıldığında 30. haftada (tablo 1). Ek olarak, başlangıç HbA'dan değişim için 5-mcg ve 10-mcg Byetta grupları arasında istatistiksel olarak anlamlı bir doz etkisi gözlenmiştir.1c 30. haftada üç çalışmada.
Oruç ve Postprandiyal Glikoz
Byetta'nın metformin, bir sülfonilüre veya her ikisi ile birlikte uzun süreli kullanımı, hem oruç tutmayı hem de Postprandiyal plazma glikoz konsantrasyonları Hafta boyunca istatistiksel olarak anlamlı, doza bağımlı bir şekilde 30. Hem açlık hem de postprandiyal glikoz konsantrasyonlarında başlangıçtan istatistiksel olarak anlamlı bir azalma 30. haftada her iki Byetta grubunda, kontrol edilen üçünden birleştirilmiş verilerdeki plasebo ile karşılaştırıldığında denemeler. Plasebo için +12 mg / dL ile karşılaştırıldığında, 30. haftada açlık glikoz konsantrasyonunda bazal ile karşılaştırıldığında değişiklik, Byetta 5 mcg BID için -8 mg / dL ve Byetta 10 mcg BID için -10 mg / dL idi. 30. Haftada Byetta'nın uygulanmasını takiben 2 saatlik postprandiyal glikoz konsantrasyonundaki değişim taban çizgisi 5 mcg BID için −63 mg / dL ve 10 mcg BID için −71 mg / dL iken, +11 mg / dL Plasebo.
HbA Alan Hasta Oranı1c≤7%
Byform, metformin, bir sülfonilüre veya her ikisi ile kombinasyon halinde, daha büyük, istatistiksel olarak anlamlı bir sonuç verdi. 30. haftada HbA1câ ‰ ¤7 elde eden hastaların oranı ile plasebo alan hastalara oranı bu ajanlar (tablo 1).
Vücut ağırlığı
Kontrollü üç çalışmada, 30. Haftadaki başlangıç vücut ağırlığındaki bir azalma, tip 2 diyabetli hastalarda plasebo BID ile karşılaştırıldığında Byetta 10 mcg BID ile ilişkili bulunmuştur (tablo 1).
Bir Yıllık Klinik Sonuçlar
Byetta 10 mcg BID ile toplam 52 haftalık tedaviyi tamamlayan 30 haftalık plasebo kontrollü çalışmalardan elde edilen 163 hastanın kohortunda başlangıçta% 1.0 ve ˆ% 1.1 oranında HbA1c değişiklikleri vardı sırasıyla 30 ve 52 haftalık tedavide, 14.0 mg / dL ve 25ˆ.3.3 mg / dL açlık plazma glikozunda başlangıçtan kaynaklanan değişikliklerle ve ˆ2.6 kg ve ˆ`3.6 vücut ağırlığı değişiklikleri ile birlikte kilogram. Bu kohortun tüm kontrollü çalışma popülasyonuna benzer temel değerleri vardı.
Tiazolidindion ile kullanım
16 haftalık randomize, çift kör, plasebo kontrollü bir çalışmada, mevcut olanlara Byetta (n = 121) veya plasebo (n = 112) eklenmiştir. Yetersiz tip 2 diyabetli hastalarda metformin içeren veya içermeyen tiazolidindion (pioglitazon veya rosiglitazon) tedavisi glisemik kontrolü. Byetta veya plaseboya randomizasyon, hastaların metformin alıp almadığına göre sınıflandırıldı. Plaseboya atanan hastalara çalışma boyunca plasebo BID'si verildi. Byetta veya plasebo sabah ve akşam yemeklerinden önce deri altına enjekte edildi. Hastaların yüzde yetmiş dokuzu tiazolidindion ve metformin,% 21'i ise yalnızca tiazolidindion kullanıyordu. Hastaların çoğunluğu (% 84) beyaz,% 8'i Hispanik ve% 3'ü Siyah idi. Ortalama bazal HbA1c değerleri Byetta ve plasebo için benzerdi (% 7.9). Byetta tedavisi 4 hafta boyunca 5 mcg BID dozunda başlatıldı, daha sonra 12 hafta daha 10 mcg BID'ye yükseldi.
On altı haftalık çalışma sonuçları Tablo 2'de özetlenmiştir. Plasebo ile karşılaştırıldığında, Byetta 16. haftada taban çizgisinden HbA1c'de istatistiksel olarak anlamlı düşüşlere neden oldu. HbA1c için tedavi etkileri, altta yatan tedavi tabakası (tiazolidindionlar ve tiazolidindionlar artı metformin) ile tanımlanan iki alt grupta benzerdi. Başlangıçtan 16 haftaya kadar açlık serum glukoz konsantrasyonundaki değişiklik, plasebo ile karşılaştırıldığında istatistiksel olarak anlamlıydı (plasebo için +4 mg / dL ile karşılaştırıldığında Byetta 10 mcg BID için <21 mg / dL).
Tablo 2: Tiazolidindion (TZD) veya Tiazolidindion artı Metformin Kullanmasına Rağmen Yetersiz Glikoz Kontrollü Hastalarda 16 Hafta Plasebo Kontrollü Byetta Denemesinin Sonuçları
| plasebo TEKLİF |
Byetta 10 mcg* TEKLİF |
|
|---|---|---|
| ||
| Bir TZD veya TZD plus MET ile Birlikte | ||
| Tedavi Etme Nüfusu (N) | 112 | 121 |
| HbA1c (%), Anlamına gelmek | ||
| Temel | 7.9 | 7.9 |
| 16. Haftadaki Değişim | +0.1 | −0.8†|
| HbA'ya Ulaşan Oran1c≤7%c | 16.2% | 62.3%†|
| Vücut Ağırlığı (kg), Ortalama | ||
| Temel | 96.9 | 97.5 |
| 16. Haftadaki Değişim | −0.2 | −1.5†|
üst
Göstergeler ve kullanımları
Byetta, metformin, bir sülfonilüre, a olan tip 2 diabetes mellituslu hastalarda glisemik kontrolü iyileştirmek için yardımcı tedavi olarak endikedir. tiazolidindion, bir metformin ve bir sülfonilüre kombinasyonu veya bir metformin ve bir tiazolidindion kombinasyonu, ancak yeterli glisemik elde etmedi kontrol.
üst
Kontrendikasyonlar
Byetta, eksenatide veya ürün bileşenlerinden herhangi birine karşı aşırı duyarlılığı olduğu bilinen hastalarda kontrendikedir.
üst
Önlemler
Genel
Byetta, insülin gerektiren hastalarda insülinin yerini tutmaz. Byetta, tip 1 diyabetli hastalarda veya diyabetik ketoasidoz tedavisinde kullanılmamalıdır.
Hastalar, protein ve peptit farmasötiklerinin potansiyel immünojenik özellikleri ile tutarlı olarak Byetta ile tedaviyi takiben anti-eksenatid antikorları geliştirebilir. Byetta alan hastalar, aşırı duyarlılık reaksiyonlarının belirti ve bulguları açısından gözlenmelidir.
Hastaların küçük bir kısmında, yüksek titrelerde anti-eksenatid antikorlarının oluşumu glisemik kontrolde yeterli iyileşme sağlanamamasına neden olabilir. Glisemik kontrolün kötüleşmesi veya hedeflenen glisemik kontrolün sağlanamaması durumunda alternatif antidiyabetik tedavi düşünülmelidir.
Byetta'nın insülin, D-fenilalanin türevleri, meglitinidler veya alfa-glukosidaz inhibitörleri ile eşzamanlı kullanımı araştırılmamıştır.
Son dönem böbrek yetmezliği veya ciddi böbrek yetmezliği olan hastalarda (kreatinin klerensi Farmakokinetik, Özel Popülasyonlar) Byetta'nın kullanılması önerilmez. Diyaliz alan son dönem böbrek yetmezliği olan hastalarda, gastrointestinal yan etkiler nedeniyle tek doz Byetta 5 mcg iyi tolere edilmemiştir.
Artmış serum da dahil olmak üzere, böbrek fonksiyonlarında nadiren kendiliğinden bildirilen olaylar olmuştur. kreatinin, böbrek yetmezliği, kötüleşen kronik böbrek yetmezliği ve akut böbrek yetmezliği, bazen hemodiyaliz. Bu olayların bazıları, böbrekleri etkilediği bilinen bir veya daha fazla farmakolojik ajan alan hastalarda meydana geldi fonksiyon / hidrasyon durumu ve / veya mide bulantısı, kusma ve / veya ishal olan veya olmayan veya olmayan hastalarda dehidratasyon. Eşlik eden ajanlar arasında anjiyotensin dönüştürücü enzim inhibitörleri, steroid olmayan antienflamatuar ilaçlar ve diüretikler vardı. Exenatid dahil potansiyel olarak nedensel ajanların destekleyici tedavisi ve kesilmesiyle, böbrek fonksiyonunun değişebildiği gözlenmiştir. Klinik öncesi veya klinik çalışmalarda eksenatidin doğrudan nefrotoksik olduğu bulunmamıştır.
Byetta gastroparezi de dahil olmak üzere ciddi gastrointestinal hastalığı olan hastalarda çalışılmamıştır. Kullanımı genellikle mide bulantısı, kusma ve ishal gibi gastrointestinal yan etkilerle ilişkilidir. Bu nedenle, şiddetli gastrointestinal hastalığı olan hastalarda Byetta kullanımı önerilmez. Byetta ile tedavi edilen bir hastada şiddetli karın ağrısının gelişimi araştırılmalıdır, çünkü ciddi bir durumun uyarı işareti olabilir.
hipoglisemi
Byetta ile yapılan 30 haftalık kontrollü klinik çalışmalarda, hipoglisemi epizodu, hastaya eşlik eden kan şekeri ile birlikte hipoglisemi ile ilişkili semptomlar bildirildi DOZAJ VE İDARESİ).
Tablo 3: Eşzamanlı Antidiyabetik Tedavi ile Hipoglisemi * insidansı (%)
| Byetta | Byetta | Byetta | |||||||
|---|---|---|---|---|---|---|---|---|---|
| plasebo TEKLİF |
5 mcg TEKLİF |
10 mcg TEKLİF |
plasebo TEKLİF |
5 mcg TEKLİF |
10 mcg TEKLİF |
plasebo TEKLİF |
5 mcg TEKLİF |
10 mcg TEKLİF |
|
| Metformin ile | Sülfonilüre ile | MET / SFU ile | |||||||
| Byetta ve plasebo sabah ve akşam yemeklerinden önce uygulandı. | |||||||||
| Kısaltmalar: BID, günde iki kez; MET / SFU, metformin ve bir sülfonilüre. | |||||||||
| |||||||||
| N- | 113 | 110 | 113 | 123 | 125 | 129 | 247 | 245 | 241 |
| hipoglisemi | 5.3% | 4.5% | 5.3% | 3.3% | 14.4% | 35.7% | 12.6% | 19.2% | 27.8% |
Metformin ile veya metformin olmadan bir tiazolidindionun eklenmesi olarak kullanıldığında, Byetta ile semptomatik hafif ila orta şiddette hipoglisemi insidansı plasebo ile% 7'ye kıyasla% 11 idi.
Byetta, sağlıklı bireylerde randomize, çift kör, kontrollü bir çalışmada insülin kaynaklı hipoglisemiye karşı düzenleyici hormon tepkilerini değiştirmedi.
Hastalar için Bilgiler
Hastalar Byetta'nın potansiyel riskleri hakkında bilgilendirilmelidir. Hastalar ayrıca Byetta'nın uygun şekilde depolanmasının önemi, enjeksiyon dahil kendi kendini yönetme uygulamaları hakkında tam olarak bilgilendirilmelidir. teknik, Byetta dozunun yanı sıra eşlik eden oral ilaçların zamanlaması, yemek planlamasına bağlılık, düzenli fiziksel aktivite, periyodik kan şekeri izleme ve HbA1c testi, hipoglisemi ve hipergliseminin tanınması ve yönetimi ve diyabetin değerlendirilmesi komplikasyonları.
Hastalara hamile olup olmadıklarını veya hamile kalmayı planladıkları takdirde doktorlarını bilgilendirmeleri tavsiye edilmelidir.
Her bir Byetta dozu, uyluk, karın veya üst kolda herhangi bir zamanda SC enjeksiyonu olarak uygulanmalıdır. Sabah ve akşam yemeklerinden 60 dakika önce (veya günün iki ana öğünden önce, yaklaşık 6 saat veya daha fazla) ayrı). Byetta bir yemekten sonra uygulanmamalıdır. Bir doz kaçırılırsa, tedavi rejimi bir sonraki planlanan dozla reçete edildiği gibi sürdürülmelidir.
Byetta, sülfonilüre gibi hipoglisemiyi indükleyen bir ajan ile birlikte kullanıldığında hipoglisemi riski artar. Hipoglisemi gelişimine yatkın semptomlar, tedavi ve durumlar hastaya açıklanmalıdır. Hastanın her zamanki hipoglisemi yönetimi talimatlarının değiştirilmesi gerekmese de, bu talimatlar Byetta tedavisine başlarken, özellikle bir sülfonilüre ile birlikte uygulandığında gözden geçirilir ve güçlendirilir (görmek ÖNLEMLER, Hipoglisemi).
Hastalara Byetta ile tedavinin iştahta, gıdada azalma ile sonuçlanabileceği bildirilmelidir. alımı ve / veya vücut ağırlığı ve buna bağlı olarak dozaj rejimini değiştirmeye gerek olmadığı Etkileri. Byetta ile tedavi, özellikle tedaviye başlandığında bulantıya da neden olabilir (bkz. TERS TEPKİLER).
Hasta, Byetta tedavisine başlamadan önce "Hasta için Bilgiler" ekini ve Kalem Kullanım Kılavuzunu okumalı ve reçete her doldurulduğunda bunları gözden geçirmelidir. Hastaya yeni bir kalemin nasıl ve ne zaman kurulacağını vurgulayan ve ilk kullanımda sadece bir kurulum adımının gerekli olduğuna dikkat ederek kalemin uygun kullanımı ve saklanması konusunda talimat verilmelidir. Hastaya kalemi ve iğneleri paylaşmamaları tavsiye edilmelidir.
Hastalara kalem iğnelerinin kalemle birlikte verilmediği ve ayrıca satın alınması gerektiği konusunda bilgi verilmelidir. Hastalara hangi iğne uzunluğunun ve göstergesinin kullanılması gerektiği bildirilmelidir.
İlaç etkileşimleri
Byetta'nın yavaş gastrik boşalmaya etkisi, oral olarak uygulanan ilaçların emilim derecesini ve oranını azaltabilir. Hızlı gastrointestinal emilim gerektiren oral ilaçlar alan hastalarda Byetta dikkatle kullanılmalıdır. Etkililik için eşik konsantrasyonlarına bağlı olan oral ilaçlar için, örneğin kontraseptifler ve antibiyotikler, hastalara bu ilaçları en az 1 saat önce almaları tavsiye edilmelidir. Byetta enjeksiyonu. Bu tür ilaçlar gıda ile uygulanacaksa, Byetta uygulanmadığında hastalara bir yemek veya atıştırmalık almaları tavsiye edilmelidir. Byetta'nın oral kontraseptiflerin emilimi ve etkinliği üzerindeki etkisi karakterize edilmemiştir.
Warfarin
Sağlıklı gönüllülerde yapılan kontrollü bir klinik farmakoloji çalışmasında, warfarin Byetta'dan 30 dakika sonra uygulandığında warfarin Tmax'ta yaklaşık 2 saatlik bir gecikme gözlenmiştir. Cmax veya AUC üzerinde klinik olarak anlamlı bir etki gözlenmemiştir. Bununla birlikte, piyasaya sunulduğundan beri kendiliğinden bildirilen bazı artmış INR vakaları olmuştur. Warfarin ve Byetta'nın eşzamanlı kullanımı ile (Uluslararası Normalleştirilmiş Oran), bazen kanama.
Karsinogenez, Mutajenez, Doğurganlık Bozukluğu
Erkek ve dişi sıçanlarda, bolus SC enjeksiyonu ile uygulanan 18, 70 veya 250 mcg / kg / gün dozlarında 104 haftalık bir kanserojenlik çalışması yapılmıştır. Tüm eksenatid dozlarında dişi sıçanlarda benign tiroid C-hücresi adenomları gözlenmiştir. Dişi sıçanlarda görülme sıklığı iki kontrol grubunda% 8 ve% 5, sistemik maruziyeti olan düşük, orta ve yüksek doz gruplarında% 14,% 11 ve% 23'tür. 5, 22 ve 130 kez, eğrinin altındaki plazma alanına (AUC) bağlı olarak önerilen maksimum 20 mcg / gün dozundan kaynaklanan insan maruziyeti.
Bolus SC enjeksiyonu ile uygulanan 18, 70 veya 250 mcg / kg / gün dozlarında farelerde yapılan 104 haftalık bir kanserojenlik çalışmasında tümör kanıtı gözlenmedi 250 mcg / kg / güne kadar olan dozlarda, önerilen maksimum 20 mcg / gün dozundan kaynaklanan insan maruziyetinin 95 katına kadar sistemik bir maruziyet, AUC.
Exenatid, Çin hamsteri yumurtalık hücrelerinde Ames bakteriyel mutajenite deneyinde veya kromozomal aberasyon deneyinde metabolik aktivasyonlu veya metabolik aktivasyon olmadan mutajenik veya klastojenik değildi. Eksenatid, in vivo fare mikronükleus analizinde negatifti.
6, 68 veya 760 mcg / kg / gün SC dozları ile fare fertilite çalışmalarında, erkekler 4 hafta önce tedavi edildi çiftleşmeye ve çiftleşmeye ve dişiler çiftleşmeden 2 hafta önce ve çiftleşme gününe kadar tedavi edildi. 7. AUC'ye dayanarak önerilen maksimum 20 mcg / gün dozundan kaynaklanan insan maruziyetinin 390 katı olan sistemik maruziyet 760 mcg / kg / gün'de doğurganlık üzerinde hiçbir olumsuz etki gözlenmemiştir.
Gebelik
Gebelik Kategorisi C
Exenatid'in farelerde fetal ve neonatal büyümede azalmaya ve iskelet etkilerine neden olduğu gösterilmiştir. sistemik olarak önerilen maksimum 20 mcg / gün dozundan kaynaklanan insan maruziyetinin 3 katı, AUC'ye dayanmaktadır. Eksenatidin, AUC'ye dayanarak önerilen maksimum 20 mcg / gün dozundan kaynaklanan insan maruziyetinin 12 katı sistemik maruziyetlerde tavşanlarda iskelet etkilerine neden olduğu gösterilmiştir. Gebe kadınlarda yeterli ve iyi kontrollü çalışma yoktur. Byetta hamilelik sırasında sadece potansiyel yarar fetusun potansiyel riskini haklı çıkarsa kullanılmalıdır.
Gebelik gününden 7 gün öncesine kadar ve çiftleşme boyunca 2 haftadan başlayarak 6, 68 veya 760 mcg / kg / gün SC dozları verilen dişi farelerde, olumsuz fetal olmadı 760 mcg / kg / güne kadar dozlarda etkiler, önerilen maksimum 20 mcg / gün dozundan kaynaklanan insan maruziyetinin 390 katına kadar sistemik maruziyet, AUC.
6. ila 15. gebelik günlerinden (organogenez), yarık damak (bazıları delikli) ve düzensiz iskeletten SC dozları 6, 68, 460 veya 760 mcg / kg / gün verilen hamile farelerde kaburga ve kafatası kemiklerinin kemikleşmesi 6 mcg / kg / gün, insan maruziyetinin 3 katı sistemik maruziyetin önerilen maksimum 20 mcg / kg / gün dozundan kaynaklanan, AUC'ye dayanmaktadır.
6. günden 18. Gebe (organogenez) 0.2, 2, 22, 156 veya 260 mcg / kg / gün SC dozları verilen gebe tavşanlarda düzensiz iskelet 2 mcg / kg / gün ossifikasyonlar gözlendi; önerilen maksimum 20 mcg / gün dozundan kaynaklanan insan maruziyetinin 12 katı sistemik maruziyet, AUC'ye dayanmaktadır.
Gebelik 6. günden laktasyon gün 20'ye (sütten kesme) kadar 6, 68 veya 760 mcg / kg / gün SC dozları verilen hamile farelerde, artan sayıda neonatal ölüm gözlenmiştir. doğum sonrası günlerde 2-4, 6 mcg / kg / gün verilen barajlarda, AUC'ye dayanarak önerilen maksimum 20 mcg / gün dozundan kaynaklanan insan maruziyetinin 3 katı sistemik maruziyet.
Emziren Anneler
Eksenatidin anne sütüne geçip geçmediği bilinmemektedir. Birçok ilaç anne sütüne geçer ve exenatide gelen emziren bebeklerde klinik olarak önemli advers reaksiyon potansiyeli nedeniyle, bir karar laktasyondaki ilacın önemini göz önünde bulundurarak tüketim için süt üretimine devam etmeme veya ilacı bırakma Kadın. Emziren farelerde yapılan çalışmalar, eksenatidin sütte düşük konsantrasyonlarda mevcut olduğunu göstermiştir (subkütan dozlamadan sonra maternal plazmada konsantrasyonun% 2.5'ünden az veya buna eşit). Emziren bir kadına Byetta uygulandığında dikkatli olunmalıdır.
Pediyatrik Kullanım
Pediatrik hastalarda Byetta'nın güvenliği ve etkinliği belirlenmemiştir.
Geriyatrik Kullanım
Byetta, 65 yaş ve üstü 282 hastada ve 75 yaş ve üstü 16 hastada incelenmiştir. Bu hastalar ve genç hastalar arasında güvenlik veya etkililik açısından fark gözlenmemiştir.
üst
Ters tepkiler
Metformin ve / veya bir sülfonilüre ile kullanım
Metformin ve / veya sülfonilüre ile yapılan 30 haftalık kontrollü Byetta eklentisinde, insidansı 5 5 ¥% 5 (hipoglisemi hariç; görmek Tablo 3), Byetta ile tedavi edilen hastalarda plasebo ile tedavi edilen hastalara göre daha sık görülen Tablo 4'te özetlenmiştir.
Tablo 4: Hipoglisemi Hariç Sık Tedavi-Ortaya Çıkan Olumsuz Olaylar (â ‰ ¥% 5 İnsidans ve Byetta Tedavisiyle Daha Fazla İnsidans) *
| Plasebo Teklifi N = 483 % |
Tüm Byetta Teklifleri N = 963 % |
|
|---|---|---|
| ||
| Mide bulantısı | 18 | 44 |
| Kusma | 4 | 13 |
| İshal | 6 | 13 |
| Gergin hissediyorum | 4 | 9 |
| Baş dönmesi | 6 | 9 |
| Baş ağrısı | 6 | 9 |
| hazımsızlık | 3 | 6 |
Byetta ile ilişkili advers olaylar genellikle hafif ila orta şiddettedir. En sık bildirilen advers olay, hafif ila orta derecede bulantı, doza bağlı bir şekilde meydana geldi. Tedaviye devam edildiğinde, başlangıçta bulantı yaşayan hastaların çoğunda frekans ve şiddet zaman içinde azaldı. Olumsuz olaylar Byetta alan hastaların â
Olumsuz olaylara bağlı yoksunluk insidansı Byetta ile tedavi edilen hastalarda% 7 ve plasebo ile tedavi edilen hastalarda% 3 idi. Byetta ile tedavi edilen hastalarda çekilmeye yol açan en yaygın advers olaylar bulantı (hastaların% 3'ü) ve kusmadır (% 1). Plasebo ile tedavi edilen hastalar için
Tiazolidindion ile kullanım
16 haftalık plasebo kontrollü Byetta'nın metformin ile veya metformin olmadan bir tiazolidindion'a eklenmesi, insidansı ve tipi gözlemlenen diğer advers olaylar metformin ve / veya a ile yapılan 30 haftalık kontrollü klinik çalışmalarda görülenlere benzerdi sülfonilüre. Plasebo kolunda ciddi bir yan etki bildirilmemiştir. Byetta kolunda, göğüs ağrısı (yoksunluğa yol açan) ve kronik aşırı duyarlılık pnömoniti olmak üzere iki ciddi yan etki bildirilmiştir.
Olumsuz olaylara bağlı çekilme insidansı Byetta ile tedavi edilen hastalarda% 16 (19/121) ve plasebo ile tedavi edilen hastalarda% 2 (2/112) idi. Byetta ile tedavi edilen hastalarda çekilmeye yol açan en yaygın advers olaylar bulantı (% 9) ve kusmadır (% 5). Plasebo ile tedavi edilen hastalar için
Kendiliğinden Veri
Byetta'nın piyasaya sürülmesinden bu yana, aşağıdaki ilave advers reaksiyonlar bildirilmiştir. Bu olaylar, belirsiz büyüklükteki bir popülasyondan gönüllü olarak bildirildiğinden, sıklıklarını güvenilir bir şekilde tahmin etmek veya ilaç maruziyeti ile nedensel bir ilişki kurmak her zaman mümkün değildir.
Genel: enjeksiyon yeri reaksiyonları; disguzi; somnolans, INR eşlik eden warfarin kullanımı ile artmıştır (kanama ile ilişkili bazı raporlar).
Alerji / Aşırı duyarlılık: genelleşmiş kaşıntı ve / veya ürtiker, maküler veya papüler döküntü, anjiyoödem; anafilaktik reaksiyonun nadir raporları.
Gastrointestinal: dehidrasyona neden olan bulantı, kusma ve / veya ishal; karın şişliği, karın ağrısı, erütasyon, kabızlık, şişkinlik, akut pankreatit.
Böbrek ve Üriner Bozukluklar: akut böbrek yetmezliği, kötüleşen kronik böbrek yetmezliği, böbrek yetmezliği, artmış serum kreatinin dahil böbrek fonksiyonlarında değişiklik (bkz. ÖNLEMLER).
İmmünojenisite
Protein ve peptit farmasötiklerinin potansiyel olarak immünojenik özelliklerine uygun olarak, hastalar Byetta ile tedaviyi takiben anti-eksenatid antikorları geliştirebilir. Antikor geliştiren hastaların çoğunda, antikor titreleri zamanla azalır.
Metformin ve / veya sülfonilüre'ye yapılan 30 haftalık kontrollü Byetta eklentilerinde, hastaların% 38'inde 30. haftada düşük titreli anti-eksenatid antikorları vardı. Bu grup için, glisemik kontrol seviyesi (HbA1c) genel olarak antikor titeri olmayanlarda gözlemlenenle karşılaştırılabilir düzeydeydi. Hastaların% 6'sında 30. haftada daha yüksek titre antikorları vardı. Bu% 6'nın yaklaşık yarısında (30 haftalık kontrollü çalışmalarda Byetta verilen toplam hastaların% 3'ü), Byetta'ya glisemik cevap zayıflatılmıştır; geri kalan, antikoru olmayan hastalarla karşılaştırılabilir bir glisemik yanıta sahipti.
Tiyazolidindionlara yapılan 16 haftalık Byetta ilavesinde, metformin ile veya metformin olmadan, hastaların% 9'unda 16. haftada daha yüksek titre antikorları vardı. Byetta'ya antikor geliştirmeyen hastalarla karşılaştırıldığında, daha yüksek titre antikorları olan hastalarda ortalama glisemik tepki zayıflatılmıştır.
Hastanın Byetta'ya verdiği glisemik yanıtı izlenmelidir. Glisemik kontrolün kötüleşmesi veya hedeflenen glisemik kontrolün sağlanamaması durumunda alternatif antidiyabetik tedavi düşünülmelidir.
üst
Doz Aşımı
Byetta'nın klinik bir çalışmasında, tip 2 diyabetli üç hastanın her birinde 100 mcg SC'lik tek bir aşırı doz yaşandı (önerilen maksimum dozun 10 katı). Doz aşımı etkileri şiddetli bulantı, şiddetli kusma ve hızla azalan kan şekeri konsantrasyonlarını içerir. Üç hastadan birinde parenteral glikoz uygulaması gerektiren ciddi hipoglisemi görülmüştür. Üç hasta komplikasyonsuz iyileşti. Doz aşımı durumunda, hastanın klinik belirti ve semptomlarına göre uygun destekleyici tedaviye başlanmalıdır.
üst
Dozaj ve Uygulama
Byetta terapisi, 60 dakika içinde herhangi bir zamanda günde iki kez uygulanan doz başına 5 mcg'de başlatılmalıdır. sabah ve akşam yemeklerinden önce (veya günün iki ana öğünden önce, yaklaşık 6 saat veya daha fazla) ayrı). Byetta bir yemekten sonra uygulanmamalıdır. Klinik yanıta dayanarak, 1 aylık tedaviden sonra Byetta'nın dozu günde iki kez 10 mcg'ye yükseltilebilir. Her doz uyluk, karın veya üst kolda bir SC enjeksiyonu olarak uygulanmalıdır.
Byetta, metformin, bir sülfonilüre, ve daha önce metformin alan tip 2 diabetes mellituslu hastalarda kullanılması tavsiye edilir. tiyazolidindion, bir metformin ve bir sülfonilüre kombinasyonu veya bir metformin ve bir tiyazolidindion kombinasyonu olup, suboptimal glisemik kontrolü. Metformin veya tiyazolidindion tedavisine Byetta eklendiğinde, metformin veya tiyazolidindionun mevcut dozu devam ettirilebilir metettain veya tiyazolidindion dozunun, Byetta ile kullanıldığında hipoglisemiye bağlı ayarlamayı gerektirmesi olası değildir. Sülfonilüre tedavisine Byetta eklendiğinde, hipoglisemi riskini azaltmak için sülfonilüre dozunda bir azalma düşünülebilir (bkz. ÖNLEMLER, Hipoglisemi).
Byetta berrak ve renksiz bir sıvıdır ve partiküller ortaya çıkarsa veya çözelti bulanık veya renkliyse kullanılmamalıdır. Byetta son kullanma tarihinden sonra kullanılmamalıdır. İntravenöz veya intramüsküler Byetta enjeksiyonunun güvenliği veya etkinliği hakkında veri yoktur.
üst
Depolama
İlk kullanımdan önce, Byetta buzdolabında 2 ° C ila 8 ° C arasında saklanmalıdır. İlk kullanımdan sonra, Byetta 25 ° C'yi aşmayan bir sıcaklıkta tutulabilir. Dondurmayın. Donmuşsa Byetta'yı kullanmayın. Byetta ışıktan korunmalıdır. Kalem, kalemde bir miktar ilaç kalsa bile ilk kullanımdan 30 gün sonra atılmalıdır.
üst
Nasıl Sağlanır
Byetta 250 mcg / mL eksenatid içeren subkütan enjeksiyon için steril bir çözelti olarak sağlanır. Aşağıdaki paketler mevcuttur:
Doz başına 5 mcg, 60 doz, 1.2 mL önceden doldurulmuş kalem NDC 66780-210-07
Doz başına 10 mcg, 60 doz, 2.4 mL önceden doldurulmuş kalem NDC 66780-210-08
SADECE Rx
Amylin Pharmaceuticals, Inc., San Diego, CA 92121 için üretilmiştir
Amylin Pharmaceuticals, Inc. tarafından pazarlanmaktadır. ve Eli Lilly ve Şirketi
1-800-868-1190
http://www.Byetta.com
Byetta, Amylin Pharmaceuticals, Inc.'in tescilli ticari markasıdır.
© 2007 Amylin Pharmaceuticals, Inc. Tüm hakları Saklıdır.
son güncelleme 09/2007
Byetta (Exenatide) Hasta Bilgisi (Sade ingilizce)
Diyabetin Belirtileri, Belirtileri, Nedenleri, Tedavileri Hakkında Detaylı Bilgi
Bu monograftaki bilgilerin olası tüm kullanımları, talimatları, önlemleri, ilaç etkileşimlerini veya yan etkileri kapsaması amaçlanmamıştır. Bu bilgiler genelleştirilmiştir ve özel tıbbi tavsiye olarak tasarlanmamıştır. Aldığınız ilaçlar hakkında sorularınız varsa veya daha fazla bilgi istiyorsanız, doktorunuza, eczacınıza veya hemşirenize danışın.
geri dön: Diyabet için tüm İlaçlara göz atın



