Diyabet Tedavisinde Avandia
Marka Adı: AVANDIA
Genel isim: rosiglitazon maleat
İçindekiler:
Göstergeler ve kullanımları
Dozaj ve Uygulama
Dozaj Formları ve Güçlü Yönleri
Kontrendikasyonlar
Uyarılar ve Önlemler
Ters tepkiler
İlaç etkileşimleri
Belirli Popülasyonlarda Kullanım
Doz Aşımı
Açıklama
Klinik Farmakoloji
Klinik Olmayan Toksikoloji
Klinik çalışmalar
Nasıl tedarik edildi
Avandia, rosiglitazon maleat, hasta bilgisi (Sade ingilizce)
UYARI
Konjestif Kalp Yetersizliği ve Miyokard İskemisi
- Rosiglitazon dahil tiazolidindionlar, bazı hastalarda konjestif kalp yetmezliğine neden olur veya şiddetlenir [bkz. UYARILAR VE ÖNLEMLER]. AVANDIA'nın başlamasından sonra ve doz arttıktan sonra, hastaları kalp yetmezliği belirtileri ve semptomları (aşırı, hızlı kilo alımı, dispne ve / veya ödem dahil) açısından dikkatle izleyin. Bu belirti ve semptomlar gelişirse, kalp yetmezliği mevcut bakım standartlarına göre yönetilmelidir. Ayrıca, AVANDIA'nın kesilmesi veya dozunun azaltılması da düşünülmelidir.
- Semptomatik kalp yetmezliği olan hastalarda AVANDIA önerilmez. NYHA Sınıf III veya IV kalp yetmezliği olan hastalarda AVANDIA'nın başlatılması kontrendikedir. [Görmek KONTRENDİKASYONLARI ve UYARILAR VE ÖNLEMLER.]
- 42 klinik çalışmanın meta-analizi (ortalama süre 6 ay; 14.237 toplam hasta), çoğu AVANDIA'yı plasebo ile karşılaştırdı, AVANDIA'nın anjina veya miyokard enfarktüsü gibi miyokardiyal iskemik olay riskinde artış ile ilişkili olduğunu gösterdi. Diğer üç çalışma (ortalama süre 41 ay; Toplam 14.067 hasta), AVANDIA'yı diğer bazı onaylanmış oral antidiyabetik ajanlar veya plasebo ile karşılaştırarak, bu riski doğrulamamış veya dışlamamıştır. Bütünüyle miyokard iskemisi riski ile ilgili mevcut veriler kesin değildir. [Görmek UYARILAR VE ÖNLEMLER.]
üst
Göstergeler ve kullanımları
Monoterapi ve Kombinasyon Tedavisi
AVANDIA, tip 2 diyabetes mellituslu yetişkinlerde glisemik kontrolü geliştirmek için diyet ve egzersize ek olarak endikedir.
Önemli Kullanım Sınırlamaları
- Etki mekanizması nedeniyle AVANDIA sadece endojen insülin varlığında aktiftir. Bu nedenle, AVANDIA tip 1 diyabetes mellituslu hastalarda veya diyabetik ketoasidoz tedavisinde kullanılmamalıdır.
- AVANDIA ve insülinin birlikte uygulanması önerilmez.
- AVANDIA'nın nitratlarla kullanılması önerilmez.
üst
Dozaj ve Uygulama
Antidiyabetik tedavinin yönetimi bireyselleştirilmelidir. Tüm hastalar AVANDIA'ya önerilen en düşük dozda başlamalıdır. AVANDIA dozundaki diğer artışlara, sıvı tutulumu ile ilgili olumsuz olaylar için dikkatli bir izleme eşlik etmelidir [bkz. Kutulu Uyarı ve UYARILAR ve ÖNLEMLER].
AVANDIA 4 mg'lık bir başlangıç dozunda günlük tek bir doz olarak veya 2 bölünmüş doz halinde uygulanabilir. Açlık plazma glikozundaki azalma ile belirlendiği gibi, 8 ila 12 haftalık tedaviyi takiben yetersiz yanıt veren hastalar için (FPG), doz monoterapi olarak veya metformin, sülfonilüre veya sülfonilüre artı ile birlikte günde 8 mg'a artırılabilir. metformin. Doz ve rejime göre glisemik parametrelerde azalma Klinik Çalışmalar altında açıklanmaktadır. AVANDIA yemekle birlikte veya yemeksiz alınabilir.
AVANDIA'nın toplam günlük dozu 8 mg'ı geçmemelidir.
monoterapi
AVANDIA'nın normal başlangıç dozu, günde bir kez tek bir doz olarak veya günde iki kez bölünmüş dozlar halinde 4 mg'dır. Klinik çalışmalarda, günde iki kez 4 mg'lık rejim, FPG ve hemoglobin A1c'de (HbA1c) en büyük azalmaya neden oldu.
Sülfonilüre veya Metformin ile Kombinasyon
AVANDIA mevcut tedaviye eklendiğinde, ajan (lar) ın mevcut doz (lar) ı AVANDIA ile tedaviye başlandıktan sonra devam ettirilebilir.
Sülfonilüre: Sülfonilüre ile kombinasyon halinde kullanıldığında, AVANDIA'nın normal başlangıç dozu günde bir kez tek bir doz olarak veya günde iki kez bölünmüş dozlar halinde 4 mg'dır. Hastalar hipoglisemi rapor ederse, sülfonilüre dozu azaltılmalıdır.
Metformin: Metformin ile kombinasyon halinde AVANDIA'nın normal başlangıç dozu, günde bir kez tek bir doz olarak veya günde iki kez bölünmüş dozlar halinde 4 mg'dır. AVANDIA ile kombinasyon tedavisi sırasında metformin dozunun hipoglisemiye bağlı olarak ayarlanması gerekecektir.
Sulfonylurea Plus Metformin ile Kombinasyon
Bir sülfonilüre artı metformin ile birlikte AVANDIA'nın normal başlangıç dozu, günde bir kez tek bir doz olarak veya günde iki kez bölünmüş dozlar halinde 4 mg'dır. Hastalar hipoglisemi rapor ederse, sülfonilüre dozu azaltılmalıdır.
Spesifik Hasta Popülasyonları
Böbrek yetmezliği: Böbrek yetmezliği olan hastalarda monoterapi olarak AVANDIA kullanıldığında doz ayarlamasına gerek yoktur. Metformin bu gibi hastalarda kontrendike olduğundan, metformin ve AVANDIA'nın birlikte uygulanması böbrek yetmezliği olan hastalarda da kontrendikedir.
Karaciğer yetmezliği: AVANDIA ile tedaviye başlamadan önce karaciğer enzimleri ölçülmelidir. Hasta aktif klinik kanıt gösteriyorsa AVANDIA ile tedaviye başlanmamalıdır. karaciğer hastalığı veya artmış serum transaminaz seviyeleri (ALT> 2.5X tedavi). AVANDIA'nın başlatılmasından sonra, karaciğer enzimleri sağlık uzmanının klinik kararı uyarınca periyodik olarak izlenmelidir. [Görmek UYARILAR ve ÖNLEMLER ve KLİNİK FARMAKOLOJİ.]
pediatrik: AVANDIA'nın pediatrik kullanımını önermek için veriler yetersizdir [bkz. ÖZEL NÜFUSLARDA KULLANIM].
üst
Dozaj formları ve güçlü yönleri
Beşgen film kaplı TILTAB tablet, maleat olarak aşağıdaki gibi rosiglitazon içerir:
- 2 mg - pembe, bir tarafta SB ve diğer tarafta 2 ile debossed
- 4 mg - turuncu, bir tarafta SB ve diğer tarafta 4 ile debossed
- 8 mg - kırmızı-kahverengi, bir tarafta SB ve diğer tarafta 8 ile debossed
üst
Kontrendikasyonlar
New York Kalp Derneği (NYHA) Sınıf III veya IV kalp yetmezliği olan hastalarda AVANDIA'nın başlatılması kontrendikedir [bkz. KUTULU UYARI].
üst
Uyarılar ve Önlemler
Kalp yetmezliği
AVANDIA, diğer tiazolidindionlar gibi, tek başına veya diğer antidiyabetik ajanlarla kombinasyon halinde, sıvı tutulmasına neden olabilir ve bu da kalp yetmezliğine neden olabilir. Hastalarda kalp yetmezliği belirti ve bulguları gözlenmelidir. Bu belirti ve semptomlar gelişirse, kalp yetmezliği mevcut bakım standartlarına göre yönetilmelidir. Ayrıca, rosiglitazonun kesilmesi veya dozunun azaltılması da düşünülmelidir [bkz. KUTULU UYARI].
AVANDIA ile tedavi edilen konjestif kalp yetmezliği (CHF) NYHA Sınıf I ve II olan hastalarda kardiyovasküler olay riski artar. Tip 2 olan 224 hastada 52 haftalık, çift kör, plasebo kontrollü ekokardiyografik çalışma yapıldı diyabetes mellitus ve arka plan antidiyabetik ve CHF'de NYHA Sınıf I veya II CHF (ejeksiyon fraksiyonu -% 45) tedavisi. Bağımsız bir komite sıvı ile ilgili olayların (aşağıdakiler dahil) kör bir değerlendirmesini yaptı konjestif kalp yetmezliği) ve önceden belirlenmiş kriterlere göre kardiyovasküler yatışlar (Yargılama). Karardan ayrı olarak, diğer kardiyovasküler yan etkiler araştırmacılar tarafından rapor edilmiştir. Her ne kadar ejeksiyon fraksiyonlarının taban çizgisinde değişiklikte herhangi bir tedavi farkı gözlenmemiş olsa da, AVANDIA ile tedaviden sonra plaseboya kıyasla kardiyovasküler advers olaylar gözlendi. 52 haftalık çalışma. (Bkz. Tablo 1.)
Tablo 1. Konjestif Kalp Yetersizliği Olan Hastalarda (NYHA Sınıf I ve II) AVANDIA veya Plasebo ile Tedavi Edilen (Arka Plan Antidiyabetik ve CHF Terapisine Ek Olarak) Acil Kardiyovasküler Yan Etkiler
| Etkinlikler | AVANDIA N = 110 n (%) |
plasebo N = 114 n (%) |
| karara | ||
| Kardiyovasküler ölümler | 5 (5%) | 4 (4%) |
| CHF kötüleşiyor | 7 (6%) | 4 (4%) |
| - geceleme | 5 (5%) | 4 (4%) |
| - gece hastaneye yatmadan | 2 (2%) | 0 (0%) |
| Yeni veya kötüleşen ödem | 28 (25%) | 10 (9%) |
| Yeni veya kötüleşen dispne | 29 (26%) | 19 (17%) |
| CHF ilacında artış | 36 (33%) | 20 (18%) |
| Kardiyovasküler hastaneye yatış * | 21 (19%) | 15 (13%) |
| Araştırmacı tarafından rapor edilen, kararsız | ||
| İskemik yan etkiler | 10 (9%) | 5 (4%) |
| - Miyokardiyal enfarktüs | 5 (5%) | 2 (2%) |
| - Angina | 6 (5%) | 3 (3%) |
| * Herhangi bir kardiyovasküler nedenden ötürü hastaneye yatmayı içerir. |
NYHA Sınıf III veya IV kalp yetmezliği olan hastalarda AVANDIA'nın başlatılması kontrendikedir. Semptomatik kalp yetmezliği olan hastalarda AVANDIA önerilmez. [Görmek KUTULU UYARI.]
Akut koroner sendromlar yaşayan hastalar kontrollü klinik çalışmalarda incelenmemiştir. Akut koroner olayı olan hastalarda kalp yetmezliği gelişme potansiyeli göz önüne alındığında, AVANDIA'nın başlatılması değildir. akut koroner olay yaşayan hastalar için tavsiye edilir ve bu akut fazda AVANDIA'nın kesilmesi düşünülen.
NYHA Sınıf III ve IV kardiyak durumu olan (CHF'li veya CHF'siz) hastalar kontrollü klinik çalışmalarda araştırılmamıştır. AVANDIA, NYHA Sınıf III ve IV kardiyak durumu olan hastalarda önerilmemektedir.
Miyokard İskemisi
42 Klinik Çalışma Grubunda Miyokard İskemisinin Meta Analizi
42 çift kör, randomize, kontrollü klinik çalışmada (ortalama süre 6 ay) bildirilen kardiyovasküler advers olayları değerlendirmek için bir meta-analiz yapıldı.1
Bu çalışmalar, tip 2 diyabette glikoz düşürücü etkinliği değerlendirmek için yapılmış ve çalışmalarda prospektif olarak planlanmış kardiyovasküler olaylara ilişkin karar verilmemiştir. Bazı çalışmalar plasebo kontrollüdür ve bazıları kontrol olarak aktif oral antidiyabetik ilaçlar kullanmıştır. Plasebo kontrollü çalışmalar monoterapi denemelerini (AVANDIA ile plasebo monoterapisine karşı monoterapi) ve ilave denemeleri (sülfonilüre, metformin veya insüline eklenen AVANDIA veya plasebo) içermektedir. Aktif kontrol çalışmaları arasında monoterapi çalışmaları (AVANDIA ile sülfonilüre veya metformine karşı monoterapi monoterapi) ve ilave denemeler (AVANDIA plus sulfonylurea veya AVANDIA plus metformin, sulfonylurea plus'a karşı) Metformin). Toplam 14.237 hasta dahil edildi (AVANDIA içeren tedavi gruplarında 8.604, karşılaştırıcı gruplar), 4,143 hasta yılı AVANDIA maruziyeti ve 2,675 hasta yılı maruziyeti karşılaştırıcı. Miyokardiyal iskemik olaylar arasında angina pektoris, anjina pektoris ağırlaştırılmış, kararsız angina, kalp durması, göğüs ağrısı, koroner arter tıkanıklığı, dispne, miyokard enfarktüsü, koroner tromboz, miyokardiyal iskemi, koroner arter hastalığı ve koroner arter bozukluk. Bu analizde, AVANDIA ile toplanmış karşılaştırıcılara karşı artmış miyokard iskemi riski (% 2 AVANDIA'ya kıyasla% 1,5 karşılaştırıcı, oran oranı 1,4,% 95 güven aralığı [CI] 1,1, 1.8). Plasebo kontrollü çalışmalarda AVANDIA ile miyokard iskemik olay riskinde artış gözlenmiştir, ancak aktif kontrollü çalışmalarda görülmemiştir. (Bkz.Şekil 1)
AVANDIA'nın eklendiği çalışmalarda miyokard iskemik olay riskinde artış gözlendi insüline (AVANDIA için% 2.8 artı insülin, plasebo artı insülin için% 1.4, [OR 2.1,% 95 CI 0.9, 5.1]). Bu artmış risk, tedavi grupları arasında 100 hasta yılı başına 3 olayın (% 95 CI -0.1, 6.3) farkını yansıtmaktadır. [Görmek UYARILAR VE ÖNLEMLER.]
Şekil 1. 42 Klinik Çalışmanın Meta-Analizinde Miyokard İskemik Olaylar için Oran Oranlarının Orman Grafiği (% 95 Güven Aralıkları)

AVANDIA ve arka plan nitrat tedavisi alan hastalarda miyokard iskemisi riski de artmıştır. Nitrat kullanıcılarındaki AVANDIA (N = 361) ve kontrole (N = 244) kıyasla, oran oranı 2,9 (% 95 CI 1,4, 5.9), nitrat dışı kullanıcılar için (toplamda yaklaşık 14.000 hasta), oran oranı 1.3 (% 95 CI 0.9, 1.7). Bu artmış risk, 100 hasta yılı başına 12 miyokard iskemik olayın farkını temsil etmektedir (% 95 GA 3.3, 21.4). Nitrat kullanıcılarının çoğu koroner kalp hastalığı tespit etmiştir. Nitrat tedavisi almayan bilinen koroner kalp hastalığı olan hastalarda AVANDIA ve karşılaştırıcıya göre miyokardiyal iskemik olay riskinde artış görülmemiştir.
AVANDIA'nın Uzun Vadeli Prospektif Rastgele Kontrollü Denemelerinde Miyokard İskemik Olaylar
AVANDIA'nın diğer 3 büyük, uzun vadeli, prospektif, randomize, kontrollü klinik çalışmasından elde edilen veriler meta-analizden ayrı olarak değerlendirildi. Bu 3 çalışma toplam 14.067 hastayı içermektedir (AVANDIA N = 6.311 içeren tedavi grupları, karşılaştırıcı gruplar N = 7.756), AVANDIA için 21.803 hasta yılı ve 25.998 hasta yılı karşılaştırıcı. Takip süresi her çalışmada 3 yılı aştı. ADOPT (A Diyabet Sonuçları Progresyon Denemesi), tip 2 diyabetli ilaç tedavisine yeni tanı konmuş hastalarda 4-6 yıllık randomize, aktif kontrollü bir çalışmadır.
Bu, dayanıklılığını incelemek için tasarlanmış bir etkinlik ve genel güvenlik denemesiydi
Sülfonilüre monoterapisi (N = 1,441) ve metformin monoterapisi (N = 1,454) ile tip 2 diyabette glisemik kontrol için monoterapi (N = 1,456) olarak AVANDIA. DREAM (Rosiglitazon ve Ramipril İlaçları ile Diyabet Azaltma Değerlendirmesi, yayınlanmış rapor2) 3- ila Glikoz toleransı bozulmuş ve / veya oruç bozukluğu olan hastalarda 5 yıllık randomize, plasebo kontrollü çalışma glikoz. AVANDIA'nın ve ayrı olarak ramiprilin (bir anjiyotensin dönüştürücü enzim inhibitörü [ACEI]) aşikar diyabete ilerleme üzerindeki etkisini değerlendirmeyi amaçlayan 2x2'lik bir faktöryel tasarıma sahipti. DREAM'de 2.635 hasta AVANDIA içeren tedavi gruplarında ve 2.634 hasta içermeyen tedavi gruplarındaydı AVANDIA.Interim sonuçları RECORD (Kardiyak Sonuçlar için Değerlendirilen Rosiglitazon ve Gliseminin Düzenlenmesi Diyabet), tip 2 diyabetli hastalarda ortalama tedaviyle devam eden açık etiketli, 6 yıllık kardiyovasküler sonuçlar çalışması süresi 3.75 yıl. KAYIT metformin veya sülfonilüre monoterapisi başarısız olan hastaları içerir; metformininde başarısız olanlar eklenti AVANDIA veya eklenti sülfonilüre almak için randomize edilir, ve sülfonilüre başarısız olanlar, eklenti AVANDIA veya eklenti almak için randomize edilir metformin. KAYIT'ta toplam 2.220 hasta AVANDIA eklentisi alıyor ve 2.227 hasta AVANDIA içermeyen ek rejimlerden birinde.
Bu 3 çalışma için analizler, bundan sonra MACE olarak anılacak olan büyük advers kardiyovasküler olayların (miyokard enfarktüsü, kardiyovasküler ölüm veya inme) bir bileşiği kullanılarak gerçekleştirildi. Bu uç nokta, yarısından fazlası anjina olan meta-analizin miyokardiyal iskemik olayların geniş uç noktasından farklıydı. Miyokard enfarktüsü, yargılanan ölümcül ve ölümcül olmayan miyokard enfarktüsü artı ani ölümdür. Şekil 2'de gösterildiği gibi, 3 uç nokta (MACE, MI ve Total Mortality) sonuçları AVANDIA ve karşılaştırıcılar arasında istatistiksel olarak anlamlı bir farklılık göstermemiştir.

DREAM çalışmasının ön analizlerinde, kardiyovasküler olayların insidansı, şekilde gösterildiği gibi, sadece ramipril alan deneklerden daha fazla ramipril ile AVANDIA aldı Şekil 2. Bu bulgu, sırasıyla hastaların% 30 ve% 40'ının başlangıçta ACE-inhibitör kullanımını bildirdiği ADOPT ve RECORD (diyabetli hastalarda aktif kontrollü çalışmalar) ile doğrulanmamıştır.
Bütünüyle miyokard iskemisi riski ile ilgili mevcut veriler kesin değildir. Bu riske ilişkin kesin sonuçlar, yeterli şekilde tasarlanmış bir kardiyovasküler sonuç çalışmasının tamamlanmasını beklemektedir.
AVANDIA veya başka herhangi bir oral antidiyabetik ilaç ile makrovasküler risk azalmasının kesin kanıtını gösteren hiçbir klinik çalışma yapılmamıştır.
AVANDIA'nın İnsülin ile Birlikte Uygulanması Sırasında Konjestif Kalp Yetmezliği ve Miyokard İskemisi
AVANDIA'nın insüline eklendiği çalışmalarda AVANDIA konjestif kalp yetmezliği ve miyokard iskemisi riskini artırdı. (Bkz. Tablo 2.)
AVANDIA ve insülinin birlikte uygulanması önerilmez. [Görmek Göstergeler ve kullanımları ve UYARILAR VE ÖNLEMLER.]
Meta analize dahil edilen beş, 26 haftalık, kontrollü, randomize, çift kör çalışmada [bkz. UYARILAR VE ÖNLEMLER], tip 2 diabetes mellituslu hastalar AVANDIA ve insülin (N = 867) veya insülinin (N = 663) birlikte uygulanmasına randomize edildi. Bu 5 çalışmada insüline AVANDIA eklenmiştir. Bu çalışmalarda uzun süredir devam eden diyabetli hastalar (ortanca süre 12 yıl) ve yüksek prevalans periferik nöropati, retinopati, iskemik kalp hastalığı, vasküler hastalık ve konjestif kalp dahil tıbbi durumlar hatası. Acil konjestif kalp yetmezliği olan toplam hasta sayısı AVANDIA artı insülin ve insülin gruplarında sırasıyla 21 (% 2.4) ve 7 (% 1.1) idi. Ortaya çıkan miyokard iskemisi olan toplam hasta sayısı AVANDIA artı insülin ve insülin gruplarında sırasıyla 24 (% 2.8) ve 9 (% 1.4) idi (OR 2.1 [% 95 CI 0.9, 5.1]). Konjestif kalp yetmezliği ve miyokard iskemisi için olay oranı düşük olmasına rağmen AVANDIA'nın birlikte uygulanmasıyla olay oranı sürekli olarak 2 kat veya daha fazlaydı. İnsülin. Bu kardiyovasküler olaylar günlük 4 mg ve 8 mg AVANDIA dozlarında kaydedildi. (Bkz. Tablo 2.)
Tablo 2. AVANDIA'nın Kurulan İnsülin Tedavisine Eklenmesi Kontrollü 5 Denemede Kardiyovasküler Olayların Oluşumu
| Etkinlik* | AVANDIA + İnsülin (n = 867) n (%) |
ensülin (n = 663) n (%) |
| Konjestif kalp yetmezliği | 21 (2.4%) | 7 (1.1%) |
| Miyokardiyal iskemi | 24 (2.8%) | 9 (1.4%) |
| Kardiyovasküler ölüm, miyokard enfarktüsü veya inme bileşimi | 10 (1.2%) | 5 (0.8%) |
| inme | 5 (0.6%) | 4 (0.6%) |
| Miyokardiyal enfarktüs | 4 (0.5%) | 1 (0.2%) |
| Kardiyovasküler ölüm | 4 (0.5%) | 1 (0.2%) |
| Tüm ölümler | 6 (0.7%) | 1 (0.2%) |
| * Olaylar münhasır değildir; yani miyokard enfarktüsüne bağlı kardiyovasküler ölümü olan bir hasta 4 olay kategorisinde (miyokard iskemisi; kardiyovasküler ölüm, miyokard enfarktüsü veya inme; miyokardiyal enfarktüs; kardiyovasküler ölüm). |
AVANDIA ve insülin birlikte uygulanmasının altıncı, 24 haftalık, kontrollü, randomize, çift kör bir çalışmasında AVANDAMET®'e insülin eklenmiştir. (rosiglitazon maleat ve metformin HC1) (n = 161) ve insülin artı plasebo (n = 158) ile karşılaştırıldığında, tek kör 8 haftalık bir alıştırmadan sonra AVANDAMET. Farmakolojik tedavi gerektiren ödemi olan hastalar ve konjestif kalp yetmezliği olan hastalar başlangıçta ve alıştırma döneminde çalışma dışı bırakıldı.
AVANDAMET artı insülin alan grupta bir miyokard iskemik olay ve bir ani ölüm meydana geldi. İnsülin grubunda miyokard iskemisi gözlenmedi ve her iki tedavi grubunda da konjestif kalp yetmezliği bildirilmedi.
Ödem
AVANDIA ödemli hastalarda dikkatle kullanılmalıdır. 8 hafta boyunca günde bir kez 8 mg AVANDIA alan sağlıklı gönüllülerde yapılan bir klinik çalışmada, plaseboya kıyasla medyan plazma hacminde istatistiksel olarak anlamlı bir artış vardı.
Rosiglitazon dahil tiazolidindionlar, sıvı tutulmasına neden olabilir, bu da alevlenebilir veya konjestif kalp yetmezliğine yol açar, AVANDIA kalp riski olan hastalarda dikkatli kullanılmalıdır hatası. Hastalar kalp yetmezliği belirtileri ve semptomları açısından izlenmelidir [bkz. KUTULU UYARI, UYARILAR VE ÖNLEMLER ].
Tip 2 diyabetli hastaların kontrollü klinik çalışmalarında AVANDIA ile tedavi edilen hastalarda hafif ila orta derecede ödem bildirilmiştir ve doza bağlı olabilir. Devam eden ödemi olan hastaların insülin ve AVANDIA ile kombinasyon tedavisine başlanırsa ödem ile ilişkili advers olaylara sahip olma olasılığı daha yüksektir [bkz. TERS TEPKİLER].
Kilo almak
Doza bağlı kilo artışı sadece AVANDIA ile ve diğer hipoglisemik ajanlarla kombinasyon halinde görülmüştür (Tablo 3). Kilo alma mekanizması belirsizdir, ancak muhtemelen sıvı tutma ve yağ birikiminin bir kombinasyonunu içerir.
Pazarlama sonrası deneyimde, klinik çalışmalarda genel olarak gözlenenlerin alışılmadık derecede hızlı arttığı ve daha fazla arttığı bildirilmiştir. Bu artışları yaşayan hastalar sıvı birikimi ve aşırı ödem ve konjestif kalp yetmezliği gibi hacimle ilişkili olaylar açısından değerlendirilmelidir [bkz. KUTULU UYARI].
Tablo 3. Klinik Araştırmalar Sırasında Uç Noktadaki Başlangıç Noktasından Ağırlık Değişimi (kg)
| monoterapi | süre | Kontrol grubu | AVANDIA 4 mg medyan (25, 75. yüzdelik) |
AVANDIA 8 mg medyan (25, 75. yüzdelik) |
|
| medyan (25, 75. yüzdelik) | |||||
| 26 hafta | plasebo | -0.9 (-2.8, 0.9) n = 210 |
1.0 (-0.9, 3.6) n = 436 |
3.1 (1.1, 5.8) n = 439 |
|
| 52 hafta | sülfonilüre | 2.0 (0, 4.0) n = 173 |
2.0 (-0.6, 4.0) n = 150 |
2.6 (0, 5.3) n = 157 |
|
| Birden fazla tedavinin bir arada uygulanması | |||||
| Sülfonilüre | 24-26 hafta | sülfonilüre | 0 (-1.0, 1.3) n = 1.155 |
2.2 (0.5, 4.0) n = 613 |
3.5 (1.4, 5.9) n = 841 |
| Metformin | 26 hafta | metformin | -1.4 (-3.2, 0.2) n = 175 |
0.8 (-1.0, 2.6) n = 100 |
2.1 (0, 4.3) n = 184 |
| ensülin | 26 hafta | ensülin | 0.9 (-0.5, 2.7) n = 162 |
4.1 (1.4, 6.3) n = 164 |
5.4 (3.4, 7.3) n = 150 |
| Sülfonilüre + metformin | 26 hafta | sülfonilüre + metformin | 0.2 (-1.2, 1.6) n = 272 |
2.5 (0.8, 4.6) n = 275 |
4.5 (2.4, 7.3) n = 276 |
4-6 yıllık bir dönemde, daha önce antidiyabetik ilaçlarla tedavi edilmemiş tip 2 diyabet tanısı konan hastalarda monoterapi, karşılaştırmalı çalışma (ADOPT) [bkz. Klinik Çalışmas], ortalama kilo değişimi (25inci, 75inci yüzde olarak) AVANDIA için 3.5 kg (0.0, 8.1), gliburid için 2.0 kg (-1.0, 4.8) ve metformin için -2.4 kg (-5.4, 0.5) idi.
Günde 4-8 mg AVANDIA ile tedavi edilen 10 ila 17 yaş arasındaki pediatrik hastalarda yapılan 24 haftalık bir çalışmada, ortalama kilo alımı 2,8 kg (25inci, 75inci persentiller: 0.0, 5.8) rapor edilmiştir.
Karaciğer Etkileri
Karaciğer enzimleri, tüm hastalarda AVANDIA ile tedaviye başlamadan önce ve daha sonra sağlık uzmanının klinik kararı uyarınca periyodik olarak ölçülmelidir. Bazal karaciğer enzim düzeyleri artmış hastalarda (ALT> 2.5X normalin üst sınırı) AVANDIA tedavisi başlatılmamalıdır. Başlangıçta hafif yüksek karaciğer enzimleri olan hastalar (ALT seviyeleri â ‰ ¤ 2.5X normalin üst sınırı) veya AVANDIA ile tedavi sırasında karaciğer enziminin nedenini belirlemek için değerlendirilmelidir yükseklik. Hafif karaciğer enzimi yükselmesi olan hastalarda AVANDIA ile tedavinin başlatılması veya sürdürülmesi dikkatle yapılmalıdır. ve karaciğer enzim yükselmelerinin çözülüp çözülmediğini belirlemek için karaciğer enzimi izlemesi de dahil olmak üzere yakın klinik takip veya kötüleşir. Herhangi bir zamanda ALT seviyeleri AVANDIA ile tedavi gören hastalarda normalin üst sınırının> 3X'e yükselirse, karaciğer enzim seviyeleri mümkün olan en kısa sürede tekrar kontrol edilmelidir. ALT seviyeleri> 3X normalin üst sınırında kalırsa, AVANDIA ile tedavi kesilmelidir.
Herhangi bir hastada açıklanamayan bulantı, kusma, karın ağrısı, yorgunluk, anoreksiya ve / veya koyu idrar içerebilen hepatik disfonksiyonu gösteren semptomlar gelişirse, karaciğer enzimleri kontrol edilmelidir. Hastanın AVANDIA ile tedaviye devam edip etmeme kararı, laboratuvar değerlendirmelerinde bekleyen klinik kararlarla yönlendirilmelidir. Sarılık gözlenirse, ilaç tedavisi kesilmelidir. [Görmek TERS TEPKİLER.]
Maküler ödem
AVANDIA veya başka bir tiazolidindion alan bazı diyabetik hastalarda pazarlama sonrası deneyimde makula ödemi bildirilmiştir. Bazı hastalar bulanık görme veya görme keskinliğinde azalma ile başvurdu, ancak bazı hastalar rutin oftalmolojik muayenede teşhis edilmiş gibi görünüyor. Makula ödemi teşhis edildiğinde hastaların çoğunda periferik ödem vardı. Bazı hastalarda tiazolidindion kesildikten sonra maküler ödemlerinde iyileşme görüldü. Diyabetli hastalar, Amerikan Diyabet Derneği Standartlarına göre bir göz doktoru tarafından düzenli göz muayenelerine tabi tutulmalıdır. Ek olarak, herhangi bir görsel semptom bildiren herhangi bir diyabetik, hastanın altta yatan ilaçlarına veya diğer fiziksel bulgularına bakılmaksızın derhal bir göz doktoruna yönlendirilmelidir. [Görmek TERS TEPKİLER.]
Kırıklar
Son zamanlarda ilaç-nave hastalarında monoterapi ile 4-6 yıllık karşılaştırmalı glisemik kontrol çalışmasında (ADOPT) Tip 2 diyabetes mellitus tanısı alan kadın hastalarda kemik kırığı insidansında artış gözlendi AVANDIA. 4-6 yıllık dönemde, kadınlarda kemik kırığı insidansı AVANDIA için% 9.3 (60/645), gliburid için% 3.5 (21/605) ve metformin için% 5.1 (30/590) idi. Bu artmış insidans tedavinin ilk yılından sonra kaydedilmiş ve çalışma süresince devam etmiştir. AVANDIA alan kadınlarda kırıkların çoğu üst kol, el ve ayakta meydana geldi. Bu kırık bölgeleri genellikle postmenopozal osteoporoz (örn. Kalça veya omurga) ile ilişkili bölgelerden farklıdır. AVANDIA ile tedavi edilen erkeklerde kırık oranlarında artış gözlenmemiştir. Tedavi edilen hastaların, özellikle kadın hastaların bakımında kırık riski göz önünde bulundurulmalıdır. AVANDIA ve kemik sağlığının mevcut standartlara göre değerlendirilmesi ve sürdürülmesine verilen önem bakım.
Hematolojik Etkiler
AVANDIA ile tedavi edilen erişkin hastalarda ortalama hemoglobin ve hematokrit dozları doza bağlı olarak ortaya çıktı [bkz. TERS TEPKİLER]. Gözlenen değişiklikler AVANDIA ile yapılan tedavide gözlenen plazma hacminin artmasıyla ilişkili olabilir.
Diyabet ve Kan Şekeri Kontrolü
AVANDIA'yı diğer hipoglisemik ajanlarla kombinasyon halinde alan hastalar hipoglisemi riski altında olabilir ve eşlik eden ajanın dozunda bir azalma gerekebilir.
Terapötik yanıtı izlemek için periyodik açlık kan şekeri ve HbA1c ölçümleri yapılmalıdır.
yumurtlama
AVANDIA ile tedavi, diğer tiazolidindionlar gibi, bazı premenopozal anovulatuar kadınlarda yumurtlamaya neden olabilir. Sonuç olarak, bu hastalar AVANDIA alırken hamilelik riski artabilir [bkz. Belirli Popülasyonlarda Kullanım]. Bu nedenle, menopoz öncesi kadınlarda yeterli kontrasepsiyon önerilmelidir. Bu olası etki klinik çalışmalarda spesifik olarak araştırılmamıştır; bu nedenle, bu oluşumun sıklığı bilinmemektedir.
Klinik öncesi çalışmalarda hormonal dengesizlik görülmesine rağmen [bkz. Klinik Olmayan Toksikoloji], bu bulgunun klinik önemi bilinmemektedir. Beklenmedik menstrüel disfonksiyon meydana gelirse, AVANDIA ile devam eden tedavinin faydaları gözden geçirilmelidir.
üst
Ters tepkiler
Klinik Araştırma Deneyimi
Yetişkin
Klinik çalışmalarda, tip 2 diyabetli yaklaşık 9.900 hasta AVANDIA ile tedavi edilmiştir.
AVANDIA'nın Monoterapi Olarak ve Diğer Hipoglisemik Ajanlarla Birlikte Kısa Dönem Çalışmaları
Monoterapi olarak AVANDIA'nın kısa süreli klinik çalışmalarında bildirilen advers olayların insidansı ve tipleri Tablo 4'te gösterilmiştir.
Çizelge 4. Olumsuz Olaylar (Herhangi Bir Tedavi Grubunda â ‰ ¥% 5) Hastalar Tarafından Kısa Süreli Bildirildi * Monoterapi olarak AVANDIA ile Çift Kör Klinik Araştırmalar
| Tercih Edilen Terim | AVANDIA monoterapi N = 2.526 % |
plasebo N = 601 % |
Metformin N = 225 % |
Sulfonylureasâ € N = 626 % |
| Üst solunum yolu enfeksiyonu | 9.9 | 8.7 | 8.9 | 7.3 |
| hasar | 7.6 | 4.3 | 7.6 | 6.1 |
| Baş ağrısı | 5.9 | 5.0 | 8.9 | 5.4 |
| Sırt ağrısı | 4.0 | 3.8 | 4.0 | 5.0 |
| Hiperglisemi | 3.9 | 5.7 | 4.4 | 8.1 |
| yorgunluk | 3.6 | 5.0 | 4.0 | 1.9 |
| Sinüzit | 3.2 | 4.5 | 5.3 | 3.0 |
| İshal | 2.3 | 3.3 | 15.6 | 3.0 |
| hipoglisemi | 0.6 | 0.2 | 1.3 | 5.9 |
|
* Kısa süreli denemeler 8 hafta ile 1 yıl arasında değişmektedir. †Gliburid (N = 514), gliklazid (N = 91) veya glipizid (N = 21) alan hastaları içerir. |
Genel olarak, AVANDIA kullanıldığında bildirilen nedensellikten bağımsız advers reaksiyon türleri bir sülfonilüre veya metformin ile kombinasyon halinde monoterapi sırasındakine benzerdi. AVANDIA.
Anemi ve ödem olayları daha yüksek dozlarda daha sık bildirilme eğilimindeydi ve genellikle hafif ila orta şiddette idi ve genellikle AVANDIA ile tedavinin kesilmesini gerektirmedi.
Çift-kör çalışmalarda, monoterapi olarak AVANDIA alan hastaların% 1.9'unda plaseboda% 0.7, sülfonilürelerde% 0.6 ve metformin'de% 2.2 anemi bildirilmiştir. AVANDIA ve metformin kombinasyonu (% 7.1) ve aşağıdakilerin kombinasyonu ile tedavi edilen hastalarda anemi raporları daha fazlaydı AVANDIA ve bir sülfonilüre ile kombinasyon halinde AVANDIA ve bir sülfonilüre artı metformin (% 6.7) (2.3%). Metformin kombinasyonu klinik çalışmalarına kayıtlı hastalarda daha düşük tedavi öncesi hemoglobin / hematokrit düzeyleri bu çalışmalarda daha yüksek anemi raporlama oranına katkıda bulunmuş olabilir [bkz. TERS TEPKİLER].
Klinik çalışmalarda, monoterapi olarak AVANDIA alan hastaların% 4.8'inde plaseboda% 1.3, sülfonilürelerde% 1.0 ve metforminde% 2.2 oranında ödem bildirilmiştir. Sülfonilüre kombinasyonlarında (% 12.4) AVANDIA 8 mg için ödem oranı, insülin hariç diğer kombinasyonlara kıyasla daha yüksekti. İnsülin kombinasyon çalışmalarında AVANDIA alan hastaların% 14.7'sinde ödem, sadece insülinde% 5.4 ile rapor edilmiştir. Konjestif kalp yetmezliğinin yeni başlangıcı veya alevlenmesi raporları, sadece insülin için% 1 ve AVANDIA ile kombinasyon halinde insülin için% 2 (4 mg) ve% 3 (8 mg) oranında gerçekleşti [bkz. KUTULU UYARI ve UYARILAR VE ÖNLEMLER].
Sülfonilüreler ile yapılan kontrollü kombinasyon terapisi çalışmalarında, doza bağlı gibi görünen hafif ila orta derecede hipoglisemik semptomlar bildirilmiştir. Çok az hasta hipoglisemi nedeniyle çekildi (UYARILAR VE ÖNLEMLER.]
Monoterapi olarak AVANDIA'nın Uzun Vadeli Denemesi
4-6 yıllık bir çalışma (ADOPT) AVANDIA (n = 1,456), gliburid (n = 1,441) ve metformin (n = 1,454) daha önce antidiyabetik ile tedavi edilmemiş tip 2 diyabet tanısı konmuş hastalarda monoterapi ilaç. Tablo 5 nedenselliğe bakılmaksızın advers reaksiyonları göstermektedir; 3 tedavi grubunda çalışma ilacına maruziyetteki farklılıkları hesaba katarak, 100 hasta yılı (PY) maruziyeti başına oranlar ifade edilmiştir.
ADOPT'ta AVANDIA ile tedavi edilen daha fazla sayıda kadında kırık bildirilmiştir (% 9.3, 2.7 / 100 hasta yılı) gliburide (% 3.5, 1.3 / 100 hasta yılı) veya metformine (% 5.1, 1.5 / 100) kıyasla Hasta-yıl).
Rosiglitazon alan kadınlarda kırıkların çoğunluğu üst kol, el ve ayakta bildirilmiştir. [Görmek UYARILAR VE ÖNLEMLERErkek hastalar için gözlenen kırık insidansı 3 tedavi grubu arasında benzerdi.
Çizelge 5. AVANDIA'nın 4-6 Yıllık Klinik Denemesinde Monoterapi (ADOPT) Olarak Bildirilen Herhangi Bir Tedavi Grubunda Tedavi Sonrası Olumsuz Olaylar (â ‰ ¥ 5 Olay / 100 Hasta Yılı [PY])
| AVANDIA N = 1.456 PY = 4.954 |
Gliburid'in N = 1.441 PY = 4.244 |
Metformin N = 1.454 PY = 4.906 |
|
| nazofarenjit | 6.3 | 6.9 | 6.6 |
| Sırt ağrısı | 5.1 | 4.9 | 5.3 |
| artralji | 5.0 | 4.8 | 4.2 |
| Hipertansiyon | 4.4 | 6.0 | 6.1 |
| Üst solunum yolu enfeksiyonu | 4.3 | 5.0 | 4.7 |
| hipoglisemi | 2.9 | 13.0 | 3.4 |
| İshal | 2.5 | 3.2 | 6.8 |
pediatrik
Avandia, 99'u Avandia ve 101'i metformin ile tedavi edilen tip 2 diyabetli pediyatrik hastaların tek, aktif kontrollü bir çalışmasında güvenlik açısından değerlendirilmiştir. Avandia veya metformin için nedensellik açısından en yaygın advers reaksiyonlar (>% 10) baş ağrısı (% 14'e karşı% 14), bulantı (% 4'e karşı% 11), nazofarenjit (% 3'e karşı% 12) ve ishal (% 1'e karşı) 13%). Bu çalışmada metformin grubunda bir diyabetik ketoasidoz olgusu bildirilmiştir. Ek olarak, rosiglitazon grubunda FPG of300 mg / dL, 2+ ketonüri ve artmış anyon boşluğu olan 3 hasta vardı.
Laboratuvar Anormallikleri
Hematolojik
Tedavi gören yetişkin hastalarda ortalama hemoglobin ve hematokrit dozları doza bağlı olarak meydana geldi Avandia ile (bireysel çalışmalarda ortalama 1.0 g / dL hemoglobin kadar ve% 3.3 kadar azalır hematokrit). Değişiklikler öncelikle Avandia ile tedaviye başlandıktan sonraki ilk 3 ay boyunca veya Avandia'da bir doz artışının ardından meydana geldi. Avandia ve diğer hipoglisemik ajanlar veya Avandia ile monoterapi kombinasyonu ile tedavi edilen hastalarda zaman seyri ve azalmanın büyüklüğü benzerdi. Metformin kombinasyon çalışmalarında tedavi öncesi hemoglobin ve hematokrit düzeyleri daha düşüktü ve daha yüksek anemi bildirme oranına katkıda bulunmuş olabilir. Pediatrik hastalarda yapılan tek bir çalışmada, hemoglobin ve hematokritte azalma (sırasıyla ortalama 0.29 g / dL ve% 0.95 azalma) bildirilmiştir. Avandia ile tedavi edilen pediatrik hastalarda hemoglobin ve hematokritte küçük düşüşler bildirilmiştir. Beyaz kan hücresi sayıları Avandia ile tedavi edilen yetişkin hastalarda da hafifçe azalmıştır. Hematolojik parametrelerde azalma, Avandia tedavisi ile gözlenen plazma hacmindeki artışla ilişkili olabilir.
Lipidler
Yetişkinlerde Avandia ile tedaviyi takiben serum lipitlerinde değişiklikler gözlenmiştir [bkz. Klinik Farmakoloji ]. 24 hafta boyunca Avandia ile tedavi edilen çocuklarda serum lipit parametrelerinde küçük değişiklikler bildirilmiştir.
Serum Transaminaz Düzeyleri
Avandia ile tedavi edilen 4.598 hastada (3.600 hasta yılı maruziyet) ve uzun vadede 4- ila ön klinik çalışmalarda Avandia ile tedavi edilen 1.456 hastada (4.954 hasta yılı maruziyeti) 6 yıllık çalışma, ilaca bağlı kanıt yoktu hepatotoksisite.
Ön onay kontrollü çalışmalarda, Avandia ile tedavi edilen hastaların% 0.2'sinde ALT> 3X'te plaseboda% 0.2 ve aktif karşılaştırıcılarda% 0.5'e kıyasla normalin üst sınırı vardı. Avandia ile tedavi edilen hastalarda ALT yükselmeleri geri dönüşümlüdür. Avandia ile tedavi edilen hastaların% 0.3'ünde hiperbilirubinemi, plasebo ile tedavi edilen% 0.9 ve aktif karşılaştırıcılar ile tedavi edilen hastalarda% 1 bulunmuştur. Ön onaylı klinik çalışmalarda, karaciğer yetmezliğine yol açan idiyosenkratik ilaç reaksiyonları vakası yoktu. [Görmek Uyarılar ve Önlemler]
4-6 yıllık ADOPT çalışmasında, Avandia (4,954 hasta yılı maruziyeti), gliburid (4,244 hasta yılı maruziyeti) veya metformin (4.906 hasta yılı maruziyeti), monoterapi olarak, ALT oranının normalin 3X üst sınırına (100 hasta yılı başına 0.3) aynı ALT artışına sahip olduğu poz).
Pazarlama Sonrası Deneyim
Klinik çalışmalardan bildirilen advers reaksiyonlara ek olarak, Avandia'nın onay sonrası kullanımı sırasında aşağıda açıklanan olaylar tanımlanmıştır. Bu olaylar, büyüklüğü bilinmeyen bir popülasyondan gönüllü olarak bildirildiğinden, sıklıklarını güvenilir bir şekilde tahmin etmek veya her zaman ilaca maruz kalma ile nedensel bir ilişki kurmak mümkün değildir.
Tiazolidindion tedavisi alan hastalarda, ölümcül sonuçları olan veya olmayan ciddi advers olaylar, potansiyel olarak hacim genişlemesi ile ilişkili (konjestif kalp yetmezliği, pulmoner ödem ve plevral efüzyonlar) [görmek Kutulu Uyarı ve Uyarılar ve Önlemler].
Avandia hepatit, hepatik enzim artışı 3 veya daha fazla olan pazarlama sonrası raporlar vardır. nedensellik henüz ortaya çıkmamasına rağmen, ölümcül sonuçlu ve ölümcül olmayan normal ve karaciğer yetmezliğinin üst sınırı kurdu.
Döküntü, kaşıntı, ürtiker, anjiyoödem, anafilaktik reaksiyon ve Stevens-Johnson sendromu nadiren bildirilmiştir.
Görme keskinliği azalmış yeni başlangıç veya kötüleşen diyabetik makula ödemi raporları da alınmıştır [bkz. Uyarılar ve Önlemler].
üst
İlaç etkileşimleri
CYP2C8 İnhibitörleri ve İndükleyicileri
Bir CYP2C8 inhibitörü (örneğin gemfibrozil), rosiglitazonun EAA'sını artırabilir ve bir CYP2C8 indükleyicisi (örn., Rifampin) rosiglitazonun EAA'sını azaltabilir. Bu nedenle, rosiglitazon tedavisi sırasında bir inhibitör veya bir CYP2C8 indükleyicisi başlatılır veya durdurulursa, klinik yanıta bağlı olarak diyabet tedavisinde değişiklik gerekebilir. [Görmek KLİNİK FARMAKOLOJİ.]
üst
Belirli Popülasyonlarda Kullanım
Gebelik
Gebelik Kategorisi C.
Tüm gebeliklerde, ilaca maruz kalmasına bakılmaksızın, doğum kusurları, kaybı veya diğer olumsuz sonuçların arka plan riski vardır. Bu arka plan riski, hiperglisemi ile komplike olan gebeliklerde artar ve iyi metabolik kontrol ile azaltılabilir. Diyabetli veya gestasyonel diyabet öyküsü olan hastaların gebe kalmadan önce ve hamilelik boyunca iyi metabolik kontrolü sürdürmesi önemlidir. Bu hastalarda glikoz kontrolünün dikkatle izlenmesi şarttır. Çoğu uzman, kan şekeri seviyelerini mümkün olduğunca normale yakın tutmak için hamilelik sırasında insülin monoterapisinin kullanılmasını önerir.
İnsan Verileri: Rosiglitazonun insan plasentasını geçtiği ve fetal dokuda yatağa tutturulduğu bildirilmiştir. Bu bulguların klinik önemi bilinmemektedir. Gebe kadınlarda yeterli ve iyi kontrollü çalışma yoktur. AVANDIA hamilelik sırasında kullanılmamalıdır.
Hayvan Çalışmaları: Sıçanlarda erken hamilelik sırasında implantasyon veya rosiglitazon tedavisi ile embriyo üzerinde hiçbir etkisi yoktu, ancak geç gebelik sırasında tedavi, hem sıçanlarda hem de tavşanlarda fetal ölüm ve büyüme geriliği ile ilişkiliydi. Teratojenisite, sıçanlarda 3 mg / kg ve tavşanlarda 100 mg / kg'a kadar olan dozlarda gözlenmemiştir (önerilen maksimum insan günlük dozu için sırasıyla insan EAA'nın yaklaşık 20 ve 75 katı). Rosiglitazon sıçanlarda plasental patolojiye neden oldu (3 mg / kg / gün). Gebelik sırasında emzirme döneminde sıçanların tedavisi, ergenlikten sonra geri dönüşümlü büyüme geriliği ile birlikte, altlık boyutunu, yenidoğan canlılığını ve doğum sonrası büyümeyi azalttı. Plasenta, embriyo / fetus ve yavrular üzerindeki etkiler için, etkisiz doz sıçanlarda 0.2 mg / kg / gün ve tavşanlarda 15 mg / kg / gün idi. Bu etkisiz seviyeler, önerilen maksimum günlük insan dozu ile insan EAA değerinin yaklaşık 4 katıdır. Rosiglitazon, yavru dişi sıçanlara 40 yaşında tedavi edildiğinde uterus implantasyonlarının ve canlı yavruların sayısını azalttı 27 günlük yaştan cinsel olgunluğa kadar mg / kg / gün (önerilen günlük maksimum maksimum insan EAA'nın yaklaşık 68 katı) doz). Etkisizlik seviyesi 2 mg / kg / gün idi (önerilen maksimum günlük dozda insan EAA'sının yaklaşık 4 katı). Doğum öncesi veya sonrası hayatta kalma veya büyüme üzerinde herhangi bir etkisi yoktu.
Emek ve Teslimat
Rosiglitazonun insanlarda doğum ve doğum üzerindeki etkisi bilinmemektedir.
Emziren Anneler
Emziren farelerden sütte ilaçla ilgili materyal tespit edildi. AVANDIA'nın anne sütüne geçip geçmediği bilinmemektedir. Birçok ilaç anne sütüne geçtiği için AVANDIA emziren bir kadına uygulanmamalıdır.
Pediyatrik Kullanım
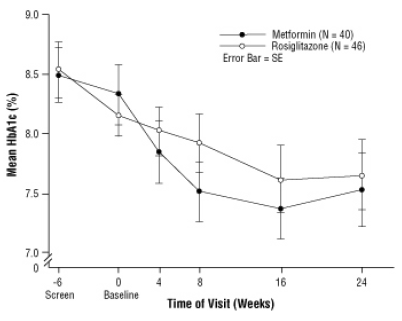
Diyet danışmanlığı dahil plasebo alıştırmasından sonra, tip 2 diyabetes mellituslu, 10 ila 17 yaş arası ve başlangıç ortalama vücut kitle indeksi (BMI) 33 olan çocuklar kg / m, 24 haftalık, çift kör bir klinikte günde iki kez 2 mg AVANDIA (n = 99) veya günde iki kez 500 mg metformin (n = 101) ile tedaviye randomize edildi. Deneme. Beklendiği gibi, diyabet ilacı olmayan hastalarda (n = 104) FPG azalmış ve alıştırma döneminde önceki ilaçlardan (genellikle metformin) (n = 90) çekilen hastalarda artmıştır. En az 8 haftalık tedaviden sonra, AVANDIA ile tedavi edilen hastaların% 49'u ve metformin ile tedavi edilen hastaların% 55'i FPG> 126 mg / dL ise dozunu iki katına çıkarmıştır. Genel olarak tedavi etme niyeti popülasyonu için, 24. haftada, HbA1c'deki taban çizgisinden ortalama değişim AVANDIA ile% -0.14 ve metformin ile% -0.49 olmuştur. Bu çalışmada, istatistiksel olarak
gözlenen ortalama tedavi etkileri benzer veya farklıdır. Antidiyabetik ilaçlarla tedaviye açık olan hastalar ve daha önce antidiyabetik tedavi ile tedavi edilen hastalar için tedavi etkileri farklıydı (Tablo 6).
Çizelge 6. 24. Hafta FPG ve HbA1c Başlangıç HbA1c'li Çocuklarda Başlangıç Son Gözlemle Taşınan İleriye Doğru Değişim HbA1c> 6.5%
| Saf Hastalar | Önceden Tedavi Edilen Hastalar | |||
|
Metformin N = 40 |
Rosiglitazon N = 45 |
Metformin N = 43 |
Rosiglitazon N = 32 |
|
| FPG (mg / dL) | ||||
| Temel (ortalama) | 170 | 165 | 221 | 205 |
| Taban çizgisinden değişim (ortalama) | -21 | -11 | -33 | -5 |
| Düzeltilmiş tedavi farkı * (rosiglitazon-metformin) - (% 95 CI) | 8 (-15, 30) |
21 (-9, 51) |
||
| mg ¥ 30 mg / dL olan hastaların yüzdesi başlangıçtan düşüyor | 43% | 27% | 44% | 28% |
| HbA1c (%) | ||||
| Temel (ortalama) | 8.3 | 8.2 | 8.8 | 8.5 |
| Taban çizgisinden değişim (ortalama) | -0.7 | -0.5 | -0.4 | 0.1 |
| Düzeltilmiş tedavi farkı * (rosiglitazon-metformin) - (% 95 CI) | 0.2 (-0.6, 0.9) |
0.5 (-0.2, 1.3) |
||
| â ¥ ¥ 0,7 olan hastaların% 'si başlangıç değerinden azalır | 63% | 52% | 54% | 31% |
|
* Taban çizgisi araçlarından değişim, en küçük karelerdir, taban çizgisi HbA1c, cinsiyet ve bölge için ayarlama anlamına gelir. †Fark için pozitif değerler metformin lehine. |
Tedavi farklılıkları başlangıçtaki VKİ veya ağırlığa bağlıydı, öyle ki AVANDIA ve metforminin etkileri daha ağır hastalar arasında daha benzer görünüyordu. Ortanca kilo artışı rosiglitazon ile 2.8 kg ve metformin ile 0.2 kg idi [bkz. UYARILAR VE ÖNLEMLER]. Rosiglitazon ile tedavi edilen hastaların yüzde elli dördü ve metformin ile tedavi edilen hastaların% 32'si â ¥ ¥ kazanmıştır. kg, ve rosiglitazon ile tedavi edilen hastaların% 33'ü ve metformin ile tedavi edilen hastaların% 7'si, ders çalışma.
Bu çalışmada gözlemlenen advers etkiler, Advers Reaksiyonlarda tanımlanmıştır).
Figür 3. Pediatrik Hastalarda AVANDIA ve Metformin ile Yapılan 24 Haftalık Bir Çalışmada Zaman İçindeki Ortalama HbA1c - İlaç-Naveve Alt Grubu
Geriyatrik Kullanım
Popülasyon farmakokinetik analiz sonuçları, yaşın rosiglitazon farmakokinetiğini önemli ölçüde etkilemediğini göstermiştir [bkz. KLİNİK FARMAKOLOJİ]. Bu nedenle, yaşlılar için herhangi bir doz ayarlamasına gerek yoktur. Kontrollü klinik çalışmalarda, yaşlı (<65 yaş) ve daha genç (<65 yaş) hastalar arasında güvenlik ve etkinlik açısından genel bir fark gözlenmemiştir.
üst
Doz Aşımı
İnsanlarda aşırı doz ile ilgili sınırlı veri mevcuttur. Gönüllülerde yapılan klinik çalışmalarda, AVANDIA 20 mg'a kadar tek oral dozlarda uygulanmıştır ve iyi tolere edilmiştir. Doz aşımı durumunda, hastanın klinik durumu tarafından belirlendiği üzere uygun destekleyici tedaviye başlanmalıdır.
üst
Açıklama
AVANDIA (rosiglitazon maleat), öncelikle insülin duyarlılığını artırarak etki eden oral bir antidiyabetik ajandır. AVANDIA dolaşımdaki insülin seviyelerini düşürürken glisemik kontrolü geliştirir.
Rosiglitazon maleat, sülfonilüreler, biguanidler veya alfa-glukosidaz inhibitörleri ile kimyasal veya fonksiyonel olarak ilişkili değildir.
Kimyasal olarak, rosiglitazon maleat (±) -5 - [[4- [2- (metil-2-piridinilamino) etoksi] fenil] metil] -2,4-tiazolidindion, (Z) -2-butendioat (1: 1) moleküler ağırlığı 473.52 (357.44 serbest baz) ile. Molekülün tek bir kiral merkezi vardır ve bir rasemat olarak bulunur. Hızlı karşılıklı dönüşüm nedeniyle, enantiyomerler fonksiyonel olarak ayırt edilemez. Rosiglitazon maleatın yapısal formülü:
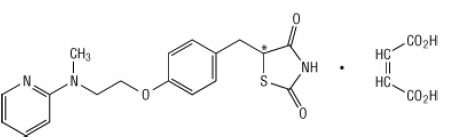
Moleküler formül C18H19N3O3S-C4H4O4'tür. Rosiglitazon maleat, erime noktası 122 ila 123 ° C olan beyaz ila kirli beyaz bir katıdır. Rosiglitazon maleatın pKa değerleri 6.8 ve 6.1'dir. Etanolde kolayca çözünür ve bir pH değeri 2.3 olan tamponlu sulu çözelti; fizyolojik olarak artan pH ile çözünürlük azalır Aralık.
Her beşgen film kaplı TILTAB tablet, oral uygulama için rosiglitazon, 2 mg, 4 mg veya 8 mg'a eşdeğer rosiglitazon maleat içerir. İnaktif bileşenler şunlardır: Hipromelloz 2910, laktoz monohidrat, magnezyum stearat, mikrokristalin selüloz, polietilen glikol 3000, sodyum nişasta glikolat, titanyum dioksit, triasetin ve aşağıdakilerin 1 veya daha fazlası: Sentetik kırmızı ve sarı demir oksitler ve talk.
üst
Klinik Farmakoloji
Hareket mekanizması
Antidiyabetik ajanların tiazolidindion sınıfının bir üyesi olan Rosiglitazon, insülin duyarlılığını artırarak glisemik kontrolü geliştirir. Rosiglitazon, peroksizom proliferatör ile aktive edilen reseptör-gama (PPARy) için oldukça seçici ve güçlü bir agonisttir. İnsanlarda PPAR reseptörleri, yağ dokusu, iskelet kası ve karaciğer gibi insülin etkisi için kilit hedef dokularda bulunur. PPARy nükleer reseptörlerinin aktivasyonu, glikoz üretimi, taşınması ve kullanımının kontrolünde yer alan insüline duyarlı genlerin transkripsiyonunu düzenler. Ek olarak, PPARy'ye duyarlı genler de yağ asidi metabolizmasının düzenlenmesine katılırlar.
İnsülin direnci tip 2 diyabet patogenezini karakterize eden yaygın bir özelliktir. Rosiglitazonun antidiyabetik aktivitesi, tip 2 diyabetli hayvan modellerinde gösterilmiştir. hangi hiperglisemi ve / veya bozulmuş glikoz toleransı hedefte insülin direncinin bir sonucudur Dokular. Rosiglitazon, ob / ob obez fare, db / db diyabetik fare ve fa / fa yağlı Zucker sıçanında kan şekeri konsantrasyonlarını azaltır ve hiperinsülinemiyi azaltır.
Hayvan modellerinde, rosiglitazonun antidiyabetik aktivitesine, insülinin karaciğer, kas ve yağ dokularındaki etkisine karşı artan duyarlılık aracılık ettiği gösterilmiştir. Hayvan modellerindeki farmakolojik çalışmalar, rosiglitazonun hepatik glukoneogenezi inhibe ettiğini göstermektedir. Yağ dokusu içinde insülin ayarlı glikoz taşıyıcı GLUT-4'ün ekspresyonu artmıştır. Rosiglitazon, tip 2 diyabet ve / veya bozulmuş glikoz toleransı hayvan modellerinde hipoglisemiye neden olmadı.
Farmakodinamik
Lipid anormallikleri olan hastalar AVANDIA'nın klinik çalışmalarından hariç tutulmadı.
26 haftalık kontrollü çalışmaların hepsinde, önerilen doz aralığında, monoterapi olarak AVANDIA, toplam kolesterol, LDL ve HDL'deki artışlar ve serbest yağ asitlerindeki azalma ile ilişkiliydi. Bu değişiklikler plasebo veya gliburid kontrollerinden istatistiksel olarak anlamlı derecede farklıydı (Tablo 7).
LDL'deki artışlar öncelikle AVANDIA ile tedavinin ilk 1 ila 2 aylık döneminde meydana gelmiştir ve LDL seviyeleri denemeler boyunca taban çizgisinin üzerinde yükselmiştir. Buna karşılık, HDL zamanla yükselmeye devam etti. Sonuç olarak, LDL / HDL oranı 2 aylık tedaviden sonra zirve yaptı ve zamanla azaldı. Lipid değişikliklerinin zamansal doğası nedeniyle, 52 haftalık gliburid kontrollü çalışma, lipitler üzerindeki uzun vadeli etkileri değerlendirmek için en uygun olandır. Başlangıçta, 26. haftada ve 52. haftada, ortalama LDL / HDL oranları, günde iki kez AVANDIA 4 mg için sırasıyla 3.1, 3.2 ve 3.0 idi. Gliburit için karşılık gelen değerler 3.2, 3.1 ve 2.9 idi. 52. haftada AVANDIA ve gliburid arasındaki bazal değişiklikteki farklar istatistiksel olarak anlamlıydı.
Diğer hipoglisemik ajanlarla kombinasyon halinde AVANDIA ile tedaviyi takiben LDL ve HDL değişiklikleri paterni genellikle monoterapide AVANDIA ile görülenlere benzerdi.
AVANDIA ile tedavi sırasında trigliseritlerdeki değişiklikler değişkendi ve genellikle plasebo veya gliburid kontrollerinden istatistiksel olarak farklı değildi.
Çizelge 7. 26 Hafta Plasebo Kontrollü ve 52 Hafta Glyburid Kontrollü Monoterapi Çalışmalarında Ortalama Lipid Değişikliklerinin Özeti
| Plasebo Kontrollü Çalışmalar 26. Hafta | Glyburide Kontrollü Çalışma 26. Hafta ve 52. Hafta | ||||||
| plasebo | AVANDIA | Glyburide Titrasyonu | AVANDIA 8 mg | ||||
| Günde 4 mg * | Günde 8 mg * | Hafta 26 | Hafta 52 | Hafta 26 | Hafta 52 | ||
| Serbest yağ asitleri | |||||||
| N- | 207 | 428 | 436 | 181 | 168 | 166 | 145 |
| Temel (ortalama)% | 18.1 | 17.5 | 17.9 | 26.4 | 26.4 | 26.9 | 26.6 |
| Taban çizgisinden değişim (ortalama) | +0.2% | -7.8% | -14.7% | -2.4% | -4.7% | -20.8% | -21.5% |
| LDL | |||||||
| N- | 190 | 400 | 374 | 175 | 160 | 161 | 133 |
| Temel (ortalama)% | 123.7 | 126.8 | 125.3 | 142.7 | 141.9 | 142.1 | 142.1 |
| Taban çizgisinden değişim (ortalama) | +4.8% | +14.1% | +18.6% | -0.9% | -0.5% | +11.9% | +12.1% |
| HDL | |||||||
| N- | 208 | 429 | 436 | 184 | 170 | 170 | 145 |
| Temel (ortalama)% | 44.1 | 44.4 | 43.0 | 47.2 | 47.7 | 48.4 | 48.3 |
| Taban çizgisinden değişim (ortalama) | +8.0% | +11.4% | +14.2% | +4.3% | +8.7% | +14.0% | +18.5% |
| * Günde bir kez ve günde iki kez doz grupları birleştirildi. |
Farmakokinetik
Rosiglitazonun maksimum plazma konsantrasyonu (Cmax) ve eğri altındaki alan (EAA) terapötik doz aralığında dozla orantılı bir şekilde artar (Tablo 8). Eliminasyon yarılanma ömrü 3-4 saattir ve dozdan bağımsızdır.
Çizelge 8. Tek Oral Dozları Takip Eden Rosiglitazon için Ortalama (SD) Farmakokinetik Parametreler (N = 32)
| Parametre | 1 mg Oruç | 2 mg Oruç | 8 mg Oruç | 8 mg Beslenmiş |
| AUC0-inf [Ng-s / ml] |
358 (112) |
733 (184) |
2,971 (730) |
2,890 (795) |
| Cmax [Ng / ml] |
76 (13) |
156 (42) |
598 (117) |
432 (92) |
| Yarım hayat [Sa] |
3.16 (0.72) |
3.15 (0.39) |
3.37 (0.63) |
3.59 (0.70) |
| CL / F * [L / saat] |
3.03 (0.87) |
2.89 (0.71) |
2.85 (0.69) |
2.97 (0.81) |
| * CL / F = Oral klerens. |
emme
Rosiglitazonun mutlak biyoyararlanımı% 99'dur. Dozlamadan yaklaşık 1 saat sonra pik plazma konsantrasyonları gözlenir. Rosiglitazonun gıda ile uygulanması, genel maruziyette (AUC) bir değişiklik ile sonuçlanmadı, ancak Cmax'ta yaklaşık% 28'lik bir azalma ve Tmax'ta (1.75 saat) bir gecikme vardı. Bu değişikliklerin klinik olarak anlamlı olması muhtemel değildir; bu nedenle AVANDIA, yiyecekle birlikte veya yemeksiz olarak uygulanabilir.
dağıtım
Rosiglitazonun ortalama (% CV) oral dağılım hacmi (Vss / F), bir popülasyon farmakokinetik analizine bağlı olarak yaklaşık 17.6 (% 30) litredir. Rosiglitazon, başta albümin olmak üzere plazma proteinlerine yaklaşık% 99,8 oranında bağlanır.
Metabolizma
Rosiglitazon, idrara atılan değişmemiş ilaç olmadan kapsamlı bir şekilde metabolize edilir. Metabolizmanın ana yolları N-demetilasyon ve hidroksilasyon, ardından sülfat ve glukuronik asit ile konjügasyon olmuştur. Tüm dolaşımdaki metabolitlerin ebeveynten önemli ölçüde daha az güçlü olması ve bu nedenle rosiglitazonun insülin duyarlılaştırıcı aktivitesine katkıda bulunması beklenmemektedir.
İn vitro veriler, rosiglitazonun ağırlıklı olarak Cytochrome P450 (CYP) izoenzim 2C8 tarafından metabolize edildiğini ve CYP2C9'un küçük bir yol olarak katkıda bulunduğunu göstermektedir.
Boşaltım
[14C] rosiglitazon maleatın oral veya intravenöz uygulanmasını takiben, dozun yaklaşık% 64'ü ve% 23'ü idrarda ve dışkıda elimine edilmiştir. [14C] ile ilişkili materyalin plazma yarı ömrü 103 ila 158 saat arasında değişmiştir.
Tip 2 Diyabetli Hastalarda Nüfus Farmakokinetiği
642 erkek ve 405 tip 2 diyabetli kadın (35 yaşında) dahil olmak üzere 3 büyük klinik çalışmadan popülasyon farmakokinetik analizleri 80 yıla kadar), rosiglitazon farmakokinetiğinin yaş, ırk, sigara içme veya alkolden etkilenmediğini gösterdi tüketimi. Hem oral klerensin (CL / F) hem de oral kararlı durum dağılım hacminin (Vss / F) vücut ağırlığındaki artışlarla arttığı gösterilmiştir. Bu analizlerde gözlenen ağırlık aralığında (50 ila 150 kg), öngörülen CL / F ve Vss / F değerleri aralığı sırasıyla <1,7 kat ve <2,3 kat değişmiştir.
Ek olarak, rosiglitazon CL / F'nin kadın hastalarda hem ağırlıktan hem de cinsiyetten etkilendiği, daha düşük (yaklaşık% 15) olduğu gösterilmiştir.
Özel Nüfuslar
yaşlı
Popülasyon farmakokinetik analiz sonuçları (n = 716 <65 yıl; n = 331 - 65 yaş) yaşın rosiglitazon farmakokinetiğini önemli ölçüde etkilemediğini göstermiştir.
Cinsiyet
Popülasyon farmakokinetik analiz sonuçları, rosiglitazonun ortalama oral klerensinin kadın hastalar (n = 405) aynı vücut ağırlığına sahip erkek hastalara kıyasla yaklaşık% 6 daha düşüktü (n = 642).
Monoterapi olarak ve metformin ile kombinasyon halinde, AVANDIA hem erkeklerde hem de kadınlarda glisemik kontrolü geliştirdi. Metformin kombinasyon çalışmalarında, glisemik yanıtta cinsiyet farklılığı olmadan etkinlik gösterilmiştir.
Monoterapi çalışmalarında, kadınlarda daha büyük bir terapötik yanıt gözlenmiştir; ancak daha obez hastalarda cinsiyet farklılıkları daha az belirgindi. Belirli bir vücut kitle indeksi (VKİ) için, dişiler erkeklerden daha fazla yağ kütlesine sahip olma eğilimindedir. Moleküler hedef PPARy, yağ dokularında eksprese edildiğinden, bu ayırt edici karakteristik, en azından kısmen, kadınlarda AVANDIA'ya daha büyük tepkiyi açıklayabilir. Terapi bireyselleştirilmesi gerektiğinden, sadece cinsiyete göre doz ayarlaması gerekmez.
Karaciğer yetmezliği
Rosiglitazonun bağlanmamış oral klerensi, orta ila şiddetli karaciğer hastalığı (Child-Pugh Sınıf B / C) olan hastalarda sağlıklı deneklere göre önemli ölçüde daha düşüktü. Sonuç olarak, bağlanmamış Cmax ve AUC0-inf sırasıyla 2 ve 3 kat artmıştır. Rosiglitazon için eliminasyon yarılanma ömrü, karaciğer hastalarında sağlıklı deneklere göre yaklaşık 2 saat daha uzundu.
Hasta aktif klinik kanıt gösteriyorsa AVANDIA ile tedaviye başlanmamalıdır. başlangıçta karaciğer hastalığı veya artmış serum transaminaz düzeyleri (ALT> 2.5X normalin üst sınırı) [görmek UYARILAR VE ÖNLEMLER].
pediatrik
Pediyatrik hastalarda rosiglitazonun farmakokinetik parametreleri, 96'dan seyrek verilerle bir popülasyon farmakokinetik analizi kullanılarak oluşturuldu 10 ila 17 yaşları arasındaki (33 ila 35 yaş arası ağırlıkları olan) 33 erkek ve 63 dişiyi kapsayan tek bir pediatrik klinik çalışmada pediatrik hastalar 178.3 kg). Rosiglitazon popülasyon ortalama CL / F ve V / F, sırasıyla 3.15 L / saat ve 13.5 L idi. Bu CL / F ve V / F tahminleri, önceki yetişkin popülasyon analizinden alınan tipik parametre tahminleriyle tutarlıdır.
Böbrek yetmezliği
Hafif olan hastalarda rosiglitazon farmakokinetiğinde klinik olarak anlamlı bir fark yoktur. böbrek yetmezliği olan veya hemodiyalize bağımlı hastalarda normal böbrek hastalarına kıyasla işlevi. Bu nedenle AVANDIA alan bu tür hastalarda doz ayarlamasına gerek yoktur. Metformin böbrek yetmezliği olan hastalarda kontrendike olduğundan, metforminin AVANDIA ile birlikte uygulanması bu hastalarda kontrendikedir.
Yarış
Kafkas, siyah ve diğer etnik kökenleri içeren popülasyon farmakokinetik analizinin sonuçları, ırkın rosiglitazon farmakokinetiği üzerinde hiçbir etkisi olmadığını göstermektedir.
İlaç-İlaç Etkileşimleri
Sitokrom P450 Tarafından Engellenen, İndükleyen veya Metabolize Olan İlaçlar
In vitro ilaç metabolizması çalışmaları, rosiglitazonun, klinik olarak anlamlı konsantrasyonlarda hiçbir ana P450 enzimini inhibe etmediğini göstermektedir. İn vitro veriler, rosiglitazonun ağırlıklı olarak CYP2C8 ve daha az ölçüde 2C9 tarafından metabolize edildiğini göstermektedir. AVANDIA'nın (günde iki kez 4 mg) farmakokinetiği üzerinde klinik olarak anlamlı bir etkisi olmadığı gösterilmiştir. ağırlıklı olarak metabolize olan nifedipin ve oral kontraseptifler (etinil estradiol ve noretindron) CYP3A4 tarafından.
gemfibrozil
Gemfibrozil (günde iki kez 600 mg), bir CYP2C8 inhibitörü ve rosiglitazon (bir kez 4 mg) ile birlikte uygulanması günlük) 7 gün boyunca rosiglitazon EAA'yı rosiglitazon uygulamasına kıyasla% 127 artırdı (günde bir kez 4 mg) tek başına. Rosiglitazon ile doza bağlı advers olay potansiyeli göz önüne alındığında, gemfibrozil verildiğinde rosiglitazon dozunda bir azalma gerekebilir [bkz. İLAÇ ETKİLEŞİMLERİ].
Rifampisin
6 gün boyunca bir CYP2C8 indükleyicisi olan rifampin uygulamasının (günde bir kez 600 mg), tek başına rosiglitazon (8 mg) uygulanmasına kıyasla rosiglitazon EAA'yı% 66 oranında azalttığı bildirilmiştir [bkz. İLAÇ ETKİLEŞİMLERİ].4
Gliburid'in
7 gün boyunca gliburid (3.75 ila 10 mg / gün) ile birlikte alınan AVANDIA (günde iki kez 2 mg) değişmedi gliburid üzerinde stabilize edilmiş diyabetik hastalarda ortalama 24 saatlik kararlı plazma glukoz konsantrasyonları tedavisi. Sağlıklı yetişkin Kafkas bireylerde 8 gün boyunca AVANDIA (günde bir kez 8 mg) dozlarını tekrarlayın, gliburid EAA ve Cmax'ta yaklaşık% 30'luk bir azalmaya neden oldu. Japon deneklerde, AVANDIA'nın birlikte uygulanmasını takiben gliburit EAA ve Cmaks biraz artmıştır.
glimepirid
14 sağlıklı yetişkin denekte tek oral glimepirid dozunun AVANDIA'nın kararlı durum farmakokinetiği üzerinde klinik olarak anlamlı bir etkisi olmamıştır. Glimepirid AUC ve C'de klinik olarak anlamlı azalma yokmaksimum sağlıklı yetişkin bireylerde 8 gün boyunca tekrarlanan AVANDIA dozlarından (günde bir kez 8 mg) gözlenmiştir.
Metformin
Sağlıklı bir şekilde AVANDIA (günde iki kez 2 mg) ve metformin (günde iki kez 500 mg) 4 gün boyunca gönüllülerin ya metforminin ya da metforminin kararlı durum farmakokinetiği üzerinde hiçbir etkisi yoktu rosiglitazon.
Akarboz
Akarbozun (günde üç kez 100 mg) sağlıklı gönüllülerde birlikte uygulanması, tek bir oral AVANDIA dozunun farmakokinetiği üzerinde klinik olarak anlamlı bir etkiye sahip değildi.
Digoksin
AVANDIA'nın oral dozajını (günde bir kez 8 mg) 14 gün boyunca tekrarlayın, sağlıklı gönüllülerde digoksinin (günde bir kez 0.375 mg) kararlı durum farmakokinetiğini değiştirmedi.
Warfarin
AVANDIA ile tekrarlanan dozlamanın warfarin enantiyomerlerinin kararlı durum farmakokinetiği üzerinde klinik olarak anlamlı bir etkisi olmamıştır.
Etanol
Orta miktarda alkolün tek bir uygulanması, AVANDIA ile tedavi edilen tip 2 diabetes mellitus hastalarında akut hipoglisemi riskini artırmamıştır.
ranitidin
Ranitidin ile ön tedavi (4 gün boyunca günde iki kez 150 mg), sağlıklı gönüllülerde tek oral veya intravenöz rosiglitazon dozlarının farmakokinetiğini değiştirmedi.
Bu sonuçlar, oral rosiglitazonun emiliminin, gastrointestinal pH'daki artışların eşlik ettiği koşullarda değişmediğini göstermektedir.
üst
Klinik Olmayan Toksikoloji
Karsinogenez, Mutajenez, Doğurganlık Bozukluğu
Karsinogenezin:
Charles River CD-1 farelerinde günde 0.4, 1.5 ve 6 mg / kg / gün dozlarında 2 yıllık bir kanserojenlik çalışması yapılmıştır. diyet (günlük önerilen maksimum insanda yaklaşık 12 kat insan EAA'sına eşdeğer en yüksek doz) doz). Sprague-Dawley sıçanlarına, 0.05, 0.3 ve 2 mg / kg / gün (günde en yüksek doz eşdeğeri) dozlarda oral gavaj ile 2 yıl süreyle doz verildi. erkek ve dişi sıçanlar için önerilen maksimum insan günlük dozunda insan EAA'sının yaklaşık 10 ila 20 katı, sırasıyla).
Rosiglitazon farede kanserojen değildi. Farede 1.5 mg / kg / gün dozlarda adipoz hiperplazi insidansında bir artış olmuştur (önerilen maksimum günlük insan dozu için insan EAA'nın yaklaşık 2 katı). Sıçanlarda, iyi huylu yağ dokusu tümörleri (lipomlar) insidansında önemli bir artış vardı. 0.3 mg / kg / gün dozlarda (önerilen maksimum günlük insan dozu ile insan EAA değerinin yaklaşık 2 katı). Her iki türdeki bu proliferatif değişiklikler, yağ dokusunun kalıcı farmakolojik aşırı uyarılması nedeniyle düşünülür.
Mutajenez:
Rosiglitazon, gen mutasyonu için in vitro bakteriyel deneylerde mutajenik veya klastojenik değildi, in vitro insan lenfositlerinde kromozom sapma testi, in vivo fare mikronükleus testi ve in vivo / in vitro sıçan UDS Deney. Metabolik aktivasyon varlığında in vitro fare lenfoma tahlilinde mutasyonda küçük (yaklaşık 2 kat) bir artış vardı.
Doğurganlığın Bozulması:
Rosiglitazon, 40 mg / kg / gün'e kadar verilen erkek sıçanların çiftleşmesi veya doğurganlığı üzerinde hiçbir etkiye sahip değildi (önerilen maksimum insan günlük dozu ile insan EAA'nın yaklaşık 116 katı). Rosiglitazon, dişi sıçanların östrojen döngüsünü (2 mg / kg / gün) ve doğurganlığı (40 mg / kg / gün) değiştirdi. progesteron ve östradiol plazma seviyeleri (önerilen maksimum günlük insan dozu ile insan EAA'nın yaklaşık 20 ve 200 katı, sırasıyla). 0.2 mg / kg / gün'de böyle bir etki kaydedilmemiştir (önerilen maksimum günlük insan dozu ile insan EAA değerinin yaklaşık 3 katı). 27 günden cinsel olgunluğa (40 mg / kg / güne kadar) dozlanan genç sıçanlarda, erkek üreme performansı üzerinde herhangi bir etkisi olmamıştır veya östrojen siklik, çiftleşme performansı veya hamilelik insidansı hakkında (önerilen günlük maksimum insanda yaklaşık 68 kat insan EAA) doz). Maymunlarda rosiglitazon (0.6 ve 4.6 mg / kg / gün; önerilen maksimum insan günlük dozunda insan EAA'nın yaklaşık 3 ve 15 katı) foliküler faz artışını azalttı luteinize edici hormon dalgalanmasında, daha düşük luteal faz progesteron seviyelerinde azalma ile serum estradiolde ve amenore. Bu etkilerin mekanizması, yumurtalık steroidogenezinin doğrudan inhibisyonu gibi görünmektedir.
Hayvan Toksikolojisi
Kalp ağırlıkları farelerde (3 mg / kg / gün), sıçanlarda (5 mg / kg / gün) ve rosiglitazonlu köpeklerde (2 mg / kg / gün) artmıştır. tedaviler (önerilen maksimum günlük insan dozu için sırasıyla insan EAA'nın yaklaşık 5, 22 ve 2 katı). Juvenil sıçanlardaki etkiler yetişkinlerde görülenlerle uyumluydu. Morfometrik ölçüm, kardiyak ventriküler dokularda, plazma hacmi genişlemesinin bir sonucu olarak artan kalp çalışmasından kaynaklanabilecek hipertrofinin olduğunu gösterdi.
üst
Klinik çalışmalar
monoterapi
Klinik çalışmalarda, AVANDIA ile tedavi, FPG ve HbA1c ile ölçülen glisemik kontrolde, insülin ve C-peptitte eş zamanlı bir azalma ile sonuçlandı. Postprandiyal glikoz ve insülin de azaldı. Bu, AVANDIA'nın bir insülin duyarlılaştırıcı olarak etki mekanizması ile tutarlıdır.
Önerilen maksimum günlük doz 8 mg'dır. Doz aralıklı çalışmalar, toplam günlük 12 mg doz ile ek bir fayda elde edilmediğini düşündürmektedir.
Kısa Süreli Klinik Çalışmalar: Daha önce tek başına diyet veya antidiyabetik ilaçlar ile tedavi edilen tip 2 diyabetli toplam 2.315 hasta, 6 çift-körde monoterapi olarak AVANDIA ile tedavi edildi. iki 26 haftalık plasebo kontrollü çalışma, bir 52 haftalık gliburid kontrollü çalışma ve 8 ila 12 haftalık süreli 3 plasebo kontrollü doz-çalışma çalışması içeren çalışmalar. Önceki antidiyabetik ilaçlar çekildi ve hastalar randomizasyondan önce 2 ila 4 haftalık plasebo alışma dönemine girdiler.
Tip 2 diyabetli (n = 1,401) yetersiz glisemik hastalarda 26 haftalık iki çift kör, plasebo kontrollü çalışma kontrol (ortalama başlangıç FPG değeri yaklaşık 228 mg / dL [101 ila 425 mg / dL] ve ortalama başlangıç HbA1c% 8,9 [% 5,2 ila% 16,2]), yürütüldü. AVANDIA ile tedavi, taban çizgisine ve plaseboya göre FPG ve HbA1c'de istatistiksel olarak anlamlı iyileşmeler sağladı. Bu çalışmalardan birindeki veriler Tablo 9'da özetlenmiştir.
Tablo 9: 26 Haftalık Plasebo Kontrollü Bir Denemede Glisemik Parametreler
| plasebo N = 173 |
AVANDIA | AVANDIA | |||
| Günde bir kez 4 mg N = 180 |
Günde iki kez 2 mg N = 186 |
Günde bir kez 8 mg N = 181 |
Günde iki kez 4 mg N = 187 |
||
| FPG (mg / dL) | |||||
| Temel (ortalama) | 225 | 229 | 225 | 228 | 228 |
| Taban çizgisinden değişim (ortalama) | 8 | -25 | -35 | -42 | -55 |
| Plasebodan fark (ayarlanmış ortalama) | - | -31* | -43* | -49* | -62* |
| mg ¥ 30 mg / dL olan hastaların yüzdesi başlangıçtan düşüyor | 19% | 45% | 54% | 58% | 70% |
| HbA1c (%) | |||||
| Temel (ortalama) | 8.9 | 8.9 | 8.9 | 8.9 | 9.0 |
| Taban çizgisinden değişim (ortalama) | 0.8 | 0.0 | -0.1 | -0.3 | -0.7 |
| Plasebodan fark (ayarlanmış ortalama) | - | -0.8* | -0.9* | -1.1* | -1.5* |
| â ¥ ¥ 0,7 olan hastaların% 'si başlangıç değerinden azalır | 9% | 28% | 29% | 39% | 54% |
| * plaseboya kıyasla p <0.0001. |
Aynı toplam günlük dozda uygulandığında, AVANDIA, günde bir kez dozlara kıyasla günde iki kez bölünmüş dozlarda uygulandığında FPG ve HbA1c'nin azaltılmasında genellikle daha etkiliydi. Bununla birlikte, HbA1c için günde bir kez 4 mg ile günde iki kez 2 mg arasındaki fark istatistiksel olarak anlamlı değildi.
Uzun Süreli Klinik Çalışmalar
Uzun süreli etki sürdürme, tip 2 diyabetli hastalarda 52 haftalık, çift kör, gliburid kontrollü bir çalışmada değerlendirildi. Hastalar 52 hafta boyunca günde iki kez AVANDIA 2 mg (N = 195) veya günde iki kez AVANDIA 4 mg (N = 189) veya gliburid (N = 202) ile tedaviye randomize edildi. Gliburid alan hastalara 2.5 mg / gün veya 5.0 mg / gün başlangıç dozu verildi. Daha sonra dozaj, glisemik kontrolü optimize etmek için önümüzdeki 12 hafta boyunca 2.5 mg / gün artışlarla maksimum 15.0 mg / gün dozuna titre edildi. Daha sonra gliburid dozu sabit tutuldu.
Ortalama titre edilmiş gliburid dozu 7.5 mg idi. Tüm tedaviler, taban çizgisinden glisemik kontrolde istatistiksel olarak anlamlı bir iyileşme ile sonuçlanmıştır (Şekil 4 ve Şekil 5). 52. haftanın sonunda, FPG ve HbA1c'deki taban çizgisinden azalma, günde iki kez AVANDIA 4 mg ile -40.8 mg / dL ve% -0.53 idi; Günde iki kez AVANDIA 2 mg ile -25.4 mg / dL ve% -0.27; ve -30.0 mg / dL ve% -0.72 gliburit ile. HbA1c için, AVANDIA 4 mg ile günde iki kez gliburid arasındaki fark 52. haftada istatistiksel olarak anlamlı değildi. FPG'de gliburid ile ilk düşüş AVANDIA'dan daha büyüktü; ancak bu etki zamanla daha az dayanıklı olmuştur.
26. haftada günde iki kez AVANDIA 4 mg ile görülen glisemik kontroldeki iyileşme çalışmanın 52. haftasında sürdürüldü.
Şekil 4. 52 Haftalık Glyburide Kontrollü Bir Çalışmada Zaman İçindeki Ortalama FPG

Şekil 5. 52 Haftalık Glyburide Kontrollü Bir Çalışmada Zaman İçindeki Ortalama HbA1c
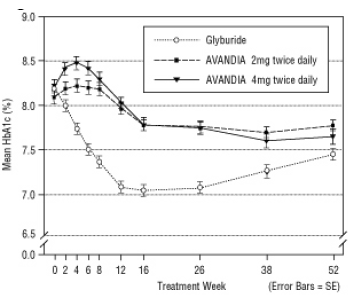
Gliburid ile tedavi edilen hastaların% 12.1'inde hipoglisemi,% 0.5'e (günde iki kez 2 mg) ve AVANDIA ile tedavi edilen hastaların% 1.6'sına (günde iki kez 4 mg) rapor edilmiştir. Glisemik kontroldeki gelişmeler, ortalama 1.75 kg ve 2.95 kg ağırlık artışı ile ilişkilendirildi. gliburid ile tedavi edilen 1.9 kg'a karşılık, günde iki kez 2 mg ve 4 mg AVANDIA ile tedavi edilen hastalar Hastalar. AVANDIA ile tedavi edilen hastalarda C-peptit, insülin, pro-insülin ve pro-insülin bölünmüş ürünler gliburid ile tedavi edilen bir artışa kıyasla, doz siparişli bir şekilde önemli ölçüde azaldı Hastalar.
Diyabet Sonuç Progresyonu Denemesi (ADOPT), güvenlik ve etkinliği karşılaştırmak için 4 ila 6 yıl boyunca yürütülen çok merkezli, çift kör, kontrollü bir çalışmadır (N = 4,351). yakın zamanda tip 2 diabetes mellitus (3 3 3 yıl) tanısı konulan hastalarda AVANDIA, metformin ve gliburid monoterapisinin tedavisi ve egzersiz yapmak. Bu çalışmadaki hastaların yaş ortalaması 57 idi ve hastaların çoğunda (% 83) bilinen bir kardiyovasküler hastalık öyküsü yoktu. Ortalama başlangıç FPG ve HbA1c sırasıyla 152 mg / dL ve% 7.4 idi. Hastalar ya günde bir kez AVANDIA 4 mg, günde bir kez 2.5 mg gliburid ya da günde bir kez 500 mg metformin alacak şekilde randomize edilmiş ve dozlar AVANDIA için günde iki kez maksimum 4 mg, gliburid için günde iki kez 7.5 mg ve günde iki kez 1000 mg'a kadar optimal glisemik kontrol için titre edilmiştir metformin. Birincil etkililik sonucu maksimum 6 hafta tedaviden sonra ardışık FPG> 180 mg / dL'ye kadar geçen süreydi bağımsız bir kararla belirlenen, çalışma ilacının tolere edilen dozu veya yetersiz glisemik kontrol zamanı Kurul.
Beşinci yılda birincil etkililik sonucunun kümülatif insidansı AVANDIA ile% 15, metformin ile% 21 ve% 34 idi. gliburit ile (metformine karşı tehlike oranı 0.68 [% 95 CI 0.55, 0.85], HR 0.37 [gliburide karşı% 95 CI 0.30, 0.45]).
AVANDIA, metformin ve gliburid için ADOPT'tan kardiyovasküler ve advers olay verileri (vücut ağırlığı ve kemik kırığı üzerindeki etkiler dahil) UYARILAR VE ÖNLEMLER ve TERS TEPKİLER, sırasıyla. Tüm ilaçlarda olduğu gibi, tek bir hastanın potansiyel fayda ve riskini değerlendirmek için etkinlik sonuçları güvenlik bilgileri ile birlikte düşünülmelidir.
Metformin veya Sülfonilüre ile Kombinasyon
AVANDIA'nın metformin veya sülfonilüre'ye eklenmesi, bu ajanlardan herhangi birine kıyasla hiperglisemide önemli azalmalar ile sonuçlandı. Bu sonuçlar AVANDIA kombinasyon terapisi olarak kullanıldığında glisemik kontrol üzerinde ilave bir etki ile tutarlıdır.
Metformin ile Kombinasyon
Tip 2 diyabetli toplam 670 hasta 26 haftalık iki randomize, çift kör, AVANDIA'nın etkinliğini değerlendirmek için tasarlanmış plasebo / aktif kontrollü çalışmalar metformin. Günde bir kez veya günde iki kez doz rejimlerinde uygulanan AVANDIA, maksimum dozda (2.5 gram / gün) metformin ile yetersiz kontrol edilen hastaların tedavisine eklenmiştir.
Bir çalışmada, hastalar 2.5 gram / gün metformin (ortalama başlangıç FPG 216 mg / dL ve ortalama başlangıç değeri) üzerinde yetersiz kontrol edildi HbA1c% 8.8) günde bir kez 4 mg AVANDIA, günde bir kez 8 mg AVANDIA veya plasebo alacak şekilde randomize edilmiştir. metformin. Kombinasyonları ile tedavi edilen hastalarda FPG ve HbA1c'de istatistiksel olarak anlamlı bir iyileşme gözlendi metformin ve günde bir kez 4 mg AVANDIA ve günde bir kez 8 mg AVANDIA, hastalara karşı sadece metformin kullanmaya devam etti (Tablo 10).
Çizelge 10. AVANDIA Plus Metformin'in 26 Haftalık Kombinasyon Çalışmasında Glisemik Parametreler
| Metformin N = 113 |
AVANDIA Günde bir kez 4 mg + metformin N = 116 |
AVANDIA Günde bir kez 8 mg + metformin N = 110 |
|
| FPG (mg / dL) | |||
| Temel (ortalama) | 214 | 215 | 220 |
| Taban çizgisinden değişim (ortalama) | 6 | -33 | -48 |
| Tek başına metformin farkı (ayarlanmış ortalama) | - | -40* | -53* |
| mg ¥ 30 mg / dL olan hastaların yüzdesi başlangıçtan düşüyor | 20% | 45% | 61% |
| HbA1c (%) | |||
| Temel (ortalama) | 8.6 | 8.9 | 8.9 |
| Taban çizgisinden değişim (ortalama) | 0.5 | -0.6 | -0.8 |
| Tek başına metformin farkı (ayarlanmış ortalama) | - | -1.0* | -1.2* |
| â ¥ ¥ 0,7 olan hastaların% 'si başlangıç değerinden azalır | 11% | 45% | 52% |
| * metformine kıyasla p <0.0001. |
26 haftalık ikinci bir çalışmada, tip 2 diyabetli hastalar günde iki kez AVANDIA 4 mg kombinasyonunu almak için randomize edilen 2.5 gram / gün metformin üzerinde yetersiz kontrol edildi ve metformin (N = 105), glisemik kontrolde -56 mg / dL FPG için ortalama tedavi etkisi ve HbA1c için ortalama% -0.8 tedavi etkisi ile istatistiksel olarak anlamlı bir gelişme gösterdi. tek başına metformin. Metformin ve AVANDIA kombinasyonu, tek tek her iki maddeden daha düşük FPG ve HbA1c seviyeleri ile sonuçlandı.
Maksimum dozda (2,5 gram / gün) metformin dozunda yetersiz kontrol edilen ve AVANDIA ile monoterapiye geçiş, FPG'deki artışlarla kanıtlandığı gibi glisemik kontrol kaybını gösterdi ve HbA1c. Bu grupta LDL ve VLDL artışları da görülmüştür.
Sülfonilüre ile Kombinasyon
Tip 2 diyabetli toplam 3,457 hasta on 24-26 haftalık randomize, çift kör, plasebo / aktif kontrollü çalışmalara ve bir AVANDIA'nın etkinliğini ve güvenliğini bir ile birlikte değerlendirmek için tasarlanmış yaşlı hastalarda 2 yıllık çift kör, aktif kontrollü çalışma sülfonilüre. AVANDIA günde 2 mg (4 çalışma) veya bölünmüş dozlar halinde günde 2 mg, 4 mg veya 8 mg uygulandı günde iki kez (7 çalışma), submaksimal veya maksimal dozda yetersiz kontrol edilen hastalara sülfonilüre.
Bu çalışmalarda, AVANDIA günde 4 mg veya 8 mg (günde tek veya iki kez bölünmüş dozlar halinde uygulanır) ve bir sülfonilüre, plasebo artı sülfonilüre veya daha fazla titrasyon ile karşılaştırıldığında FPG ve HbA1c'yi önemli ölçüde azalttı sülfonilüre. Tablo 11, sülfonilüre'ye eklenen AVANDIA'nın plasebo artı sülfonilüre ile karşılaştırıldığı 8 çalışma için havuzlanmış verileri göstermektedir.
Çizelge 11. AVANDIA Plus Sulfonylurea'nın 24-26 Haftalık Kombinasyon Çalışmalarında Glisemik Parametreler
| Günde İki Bölünmüş Dozlama (5 Çalışma) | Sülfonilüre N = 397 |
AVANDIA Günde iki kez 2 mg + sülfonilüre N = 497 |
Sülfonilüre N = 248 |
AVANDIA Günde iki kez 4 mg + sülfonilüre N = 346 |
| FPG (mg / dL) | ||||
| Temel (ortalama) | 204 | 198 | 188 | 187 |
| Taban çizgisinden değişim (ortalama) | 11 | -29 | 8 | -43 |
| Tek başına sülfonilüre farkı (ayarlanmış ortalama) | - | -42* | - | -53* |
| mg ¥ 30 mg / dL olan hastaların yüzdesi başlangıçtan düşüyor | 17% | 49% | 15% | 61% |
| HbA1c (%) | ||||
| Temel (ortalama) | 9.4 | 9.5 | 9.3 | 9.6 |
| Taban çizgisinden değişim (ortalama) | 0.2 | -1.0 | 0.0 | -1.6 |
| Tek başına sülfonilüre farkı (ayarlanmış ortalama) | - | -1.1* | - | -1.4* |
| â ¥ ¥ 0,7 olan hastaların% 'si başlangıç değerinden azalır | 21% | 60% | 23% | 75% |
| Günde Bir Dozlama (3 Çalışma) | Sülfonilüre N = 172 |
AVANDIA Günde bir kez 4 mg + sülfonilüre N = 172 |
Sülfonilüre N = 173 |
AVANDIA Günde bir kez 8 mg + sülfonilüre N = 176 |
| FPG (mg / dL) | ||||
| Temel (ortalama) | 198 | 206 | 188 | 192 |
| Taban çizgisinden değişim (ortalama) | 17 | -25 | 17 | -43 |
| Tek başına sülfonilüre farkı (ayarlanmış ortalama) | - | -47* | - | -66* |
| mg ¥ 30 mg / dL olan hastaların yüzdesi başlangıçtan düşüyor | 17% | 48% | 19% | 55% |
| HbA1c (%) | ||||
| Temel (ortalama) | 8.6 | 8.8 | 8.9 | 8.9 |
| Taban çizgisinden değişim (ortalama) | 0.4 | -0.5 | 0.1 | -1.2 |
| Tek başına sülfonilüre farkı (ayarlanmış ortalama) | - | -0.9* | - | -1.4* |
| â ¥ ¥ 0,7 olan hastaların% 'si başlangıç değerinden azalır | 11% | 36% | 20% | 68% |
| * sadece sülfonilüre ile karşılaştırıldığında p <0.0001. |
24-26 haftalık çalışmalardan biri, azami dozlarda gliburid üzerinde yetersiz kontrol edilen ve monoterapi olarak günde 4 mg AVANDIA'ya geçen hastaları; bu grupta, FPG ve HbA1c'deki artışlarla kanıtlandığı gibi glisemik kontrol kaybı gösterilmiştir.
2 yıllık çift kör bir çalışmada, yarı maksimal sülfonilüre (günde iki kez 10 mg glipizid) kullanan yaşlı hastalar (59-89 yaş arası) AVANDIA (n = 115, günde bir kez 4 mg, gerekirse 8 mg'a) veya glipizidin (n = 110) titrasyonunun devam ettirilmesi için, maksimum 20 mg'a iki kez günlük. Ortalama taban FPG ve HbA1c, AVANDIA plus glipizid kolu için sırasıyla 157 mg / dL ve% 7.72 ve glipizid yukarı titrasyon kolu için sırasıyla 159 mg / dL ve% 7.65 idi. AVANDIA plus glipizid hastalarında glipizid yukarı titrasyon kolundaki hastalara (% 28.7) kıyasla daha düşük oranda (% 2) glisemik kontrol kaybı (FPG â ‰ ¥ 180 mg / dL) görülmüştür. Kombinasyon tedavisi alan hastaların yaklaşık% 78'i 2 yıllık tedaviyi tamamlarken sadece% 51'i glipizid monoterapisinde tamamlanmıştır. Kombinasyon tedavisinin FPG ve HbA1c üzerindeki etkisi, 2 yıllık çalışma süresi boyunca, glipizidde hiçbir değişikliğe kıyasla FPG için ortalama 132 mg / dL ve HbA1c için ortalama% 6.98 elde edildi kol.
Sulfonylurea Plus Metformin ile Kombinasyon
24-26 haftalık iki çift kör, plasebo kontrollü çalışmada, AVANDIA'nın sülfonilüre artı metformin, AVANDIA 4 mg veya 8 mg ile kombinasyon halinde etkinliğini ve güvenliğini değerlendirmek için tasarlanmış çalışmalar günlük olarak, submaksimal (10 mg) ve maksimal (20 mg) dozlarda gliburid ve maksimum metformin (2 doz) üzerinde yetersiz kontrol edilen hastalara günde iki kez bölünmüş dozlarda uygulandı. iyi günler). Sülfonilüre kombinasyonları ile tedavi edilen hastalarda FPG ve HbA1c'de istatistiksel olarak anlamlı bir iyileşme gözlendi artı metformin ve 4 mg AVANDIA ve 8 mg AVANDIA hastalara karşı Tabloda gösterildiği gibi sülfonilüre artı metformin üzerinde devam etti 12.
Çizelge 12. AVANDIA Plus Sulfonylurea ve Metformin'in 26 Haftalık Kombinasyon Çalışmasında Glisemik Parametreler
| Sülfonilüre + metformin N = 273 |
AVANDIA 2 mg iki kez günlük + sülfonilüre + metformin N = 276 |
AVANDIA Günde iki kez 4 mg + sülfonilüre + metformin N = 277 |
|
| FPG (mg / dL) | |||
| Temel (ortalama) | 189 | 190 | 192 |
| Taban çizgisinden değişim (ortalama) | 14 | -19 | -40 |
| Sülfonilüre artı metforminden fark (ayarlanmış ortalama) | - | -30* | -52* |
| mg ¥ 30 mg / dL olan hastaların yüzdesi başlangıçtan düşüyor | 16% | 46% | 62% |
| HbA1c (%) | |||
| Temel (ortalama) | 8.7 | 8.6 | 8.7 |
| Taban çizgisinden değişim (ortalama) | 0.2 | -0.4 | -0.9 |
| Sülfonilüre artı metforminden fark (ayarlanmış ortalama) | - | -0.6* | -1.1* |
| â ¥ ¥ 0,7 olan hastaların% 'si başlangıç değerinden azalır | 16% | 39% | 63% |
| * plaseboya kıyasla p <0.0001. |
üst
Referanslar
- Gıda ve İlaç İdaresi Bilgilendirme Belgesi. Endokrinolojik Metabolik İlaçlar ve İlaç Güvenliği ve Risk Yönetimi Danışma Komiteleri ortak toplantısı. Ju 2007.
- DREAM Deneme Müfettişleri. Rosiglitazonun bozulmuş glikoz toleransı veya bozulmuş açlık glikozu ile diyabet sıklığı üzerindeki etkisi: randomize bir kontrol neşter 2006;368:1096-1105.
- Home PD, Pocock SJ, Beck-Nielsen H, vd. Rosiglitazon kardiyovasküler sonuçlar için değerlendirildi - bir ara analiz. NEJM 2007; 357: 1-11.
- Park JY, Kim KA, Kang MH, vd. Rifampinin sağlıklı bireylerde rosiglitazon farmakokinetiği üzerine etkisi. Clin Pharmacol Ther 2004; 75: 157-162.
üst
Nasıl Sağlanır / Depolama ve Kullanım
Her beşgen film kaplı TILTAB tablet, maleat olarak aşağıdaki gibi rosiglitazon içerir: 2 mg pembe, bir tarafta SB ve diğer tarafta 2 ile debossed; 4 mg-turuncu, bir tarafta SB ve diğer tarafta 4 ile debossed; 8 mg-kırmızı-kahverengi, bir tarafında SB, diğer tarafında 8 ile debossed.
- 2 mg 60 şişe: NDC 0029-3158-18
- 4 mg 30 şişe: NDC 0029-3159-13
- 4 mg'lık 90 şişe: NDC 0029-3159-00
- 8 mg 30 şişe: NDC 0029-3160-13
- 8 mg'lık 90 şişe: NDC 0029-3160-59
25 ° C'de (77 ° F) saklayın; geziler 15 ila 30 C (59 ila 86 F). Sıkı, ışığa dayanıklı bir kapta dağıtın.
son güncelleme 02/2008
Avandia, rosiglitazon maleat, hasta bilgisi (Sade ingilizce)
Diyabetin Belirtileri, Belirtileri, Nedenleri, Tedavileri Hakkında Detaylı Bilgi
Bu monograftaki bilgilerin olası tüm kullanımları, talimatları, önlemleri, ilaç etkileşimlerini veya yan etkileri kapsaması amaçlanmamıştır. Bu bilgiler genelleştirilmiştir ve özel tıbbi tavsiye olarak tasarlanmamıştır. Aldığınız ilaçlar hakkında sorularınız varsa veya daha fazla bilgi istiyorsanız, doktorunuza, eczacınıza veya hemşirenize danışın.
geri dön:Diyabet için tüm İlaçlara göz atın


