Diyabet Tedavisi için Onglyza
Marka Adı: Onglyza
Jenerik Adı: Saxagliptin
Dozaj Formu: tablet, film kaplı
İçindekiler:
Göstergeler ve kullanımları
Dozaj ve Uygulama
Dozaj Formları ve Güçlü Yönleri
Kontrendikasyonlar
Uyarılar ve Önlemler
Ters tepkiler
İlaç etkileşimleri
Belirli Popülasyonlarda Kullanım
Doz Aşımı
Açıklama
Farmakoloji
Klinik Olmayan Toksikoloji
Klinik çalışmalar
Nasıl tedarik edildi
Onglyza hasta bilgisi (Sade ingilizce)
Göstergeler ve kullanımları
Monoterapi ve Kombinasyon Tedavisi
Onglyza, tip 2 diyabetes mellituslu yetişkinlerde glisemik kontrolü geliştirmek için diyet ve egzersize ek olarak endikedir. [Görmek Klinik çalışmalar].
Önemli Kullanım Sınırlamaları
Onglyza, bu ortamlarda etkili olmayacağından tip 1 diabetes mellitus veya diyabetik ketoasidoz tedavisinde kullanılmamalıdır.
Onglyza, insülin ile kombinasyon halinde çalışılmamıştır.
üst
Dozaj ve Uygulama
Önerilen Doz
Onglyza'nın önerilen dozu, yemeklerden bağımsız olarak günde bir kez 2.5 mg veya 5 mg'dır.
Böbrek yetmezliği olan hastalar
Hafif böbrek yetmezliği olan hastalarda (kreatinin klerensi [CrCl]> 50 mL / dak) Onglyza için doz ayarlaması önerilmez.
Onglyza dozu, orta veya şiddetli böbrek yetmezliği olan hastalar için günde bir kez 2.5 mg'dır veya hemodiyaliz (kreatinin klerensi [CrCl] gerektiren son dönem böbrek yetmezliği (SDBY) olan â ‰ ¤50 mL / dakika). Hemodiyalizden sonra Onglyza uygulanmalıdır. Periton diyalizi uygulanan hastalarda Onglyza araştırılmamıştır.
Onglyza'nın dozu böbrek fonksiyonuna bağlı olarak 2.5 mg ile sınırlı olması gerektiğinden, Onglyza'nın başlatılmasından önce ve daha sonra periyodik olarak böbrek fonksiyonunun değerlendirilmesi önerilir. Böbrek fonksiyonu, Cockcroft-Gault formülü veya Böbrek Hastalığında Diyet Değişikliği formülü kullanılarak serum kreatinininden tahmin edilebilir. [Görmek Klinik Farmakoloji, Farmakokinetik.]
Güçlü CYP3A4 / 5 İnhibitörleri
Onglyza dozu, güçlü sitokrom P450 3A4 / 5 (CYP3A4 / 5) inhibitörleri (örn. ketokonazol, atazanavir, klaritromisin, indinavir, itrakonazol, nefazodon, nelfinavir, ritonavir, sakinavir ve telitromisin). [Görmek İlaç etkileşimleri, CYP3A4 / 5 Enzimlerinin İnhibitörleri ve Klinik Farmakoloji, Farmakokinetik.]
üst
Dozaj Formları ve Güçlü Yönleri
- Onglyza (saksagliptin) 5 mg tabletler pembe, bikonveks, yuvarlak, film kaplı tabletler olup, bir tarafında "5" ve arka yüzünde mavi mürekkeple "4215" basılmıştır.
- Onglyza (saksagliptin) 2.5 mg tabletler soluk sarı ila açık sarı, bikonveks, yuvarlak, film kaplı tabletler, bir tarafta "2.5" ve arka tarafta "4214" mavi mürekkeple basılmıştır.
üst
Kontrendikasyonlar
Yok.
üst
Uyarılar ve Önlemler
Hipoglisemiye Neden Olduğu Bilinen İlaçlarla Kullanım
Sülfonilüreler gibi insülin sekretagogları hipoglisemiye neden olur. Bu nedenle, Onglyza ile kombinasyon halinde kullanıldığında hipoglisemi riskini azaltmak için daha düşük bir insülin salgılatıcı dozu gerekebilir. [Görmek Ters tepkiler, Klinik Araştırmalar Deneyimi.]
Makrovasküler Sonuçlar
Onglyza veya diğer herhangi bir antidiyabetik ilaç ile makrovasküler risk azaltımına dair kesin kanıtlar sunan hiçbir klinik çalışma yapılmamıştır.
üst
Ters tepkiler
Klinik Araştırmalar Deneyimi
Klinik araştırmalar çok değişken koşullar altında gerçekleştirildiğinden, bir klinik araştırmada gözlenen advers reaksiyon oranları ilaç, başka bir ilacın klinik çalışmalarındaki oranlarla doğrudan karşılaştırılamaz ve uygulama.
Monoterapi ve Ek Kombinasyon Tedavisi
24 haftalık iki plasebo kontrollü monoterapi çalışmasında hastalar günde 2,5 mg Onglyza, günde 5 mg Onglyza ve plasebo ile tedavi edildi. Üç adet 24 haftalık plasebo kontrollü eklenti kombinasyon terapisi çalışması da gerçekleştirildi: biri metformin, biri tiazolidindion (pioglitazon veya rosiglitazon) ve diğeri gliburid. Bu üç çalışmada, hastalar günde 2.5 mg Onglyza, günde 5 mg Onglyza veya plasebo ile ek tedaviye randomize edildi. Monoterapi denemelerinden birine ve metformin ile yapılan ilave kombinasyon denemesine 10 mg bir saksagliptin tedavi kolu dahil edilmiştir.
İki monoterapi denemesinden alınan 24 haftalık verilerin (glisemik kurtarmaya bakılmaksızın) önceden belirlenmiş birleştirilmiş analizinde, metformin denemesine eklenti, tiazolidindion (TZD) denemesine eklenti, ve glyburid çalışmasına ek olarak, Onglyza 2.5 mg ve Onglyza 5 mg ile tedavi edilen hastalarda genel advers olay insidansı plasebo ile benzerdi (% 72.0 ve% 72.2,% 70.6, sırasıyla). Advers olaylara bağlı tedavinin kesilmesi, Onglyza 2.5 mg, Onglyza 5 mg ve plasebo alan hastaların sırasıyla% 2.2,% 3.3 ve% 1.8'inde meydana geldi. En yaygın yan etkiler (Onglyza ile tedavi edilen en az 2 hastada 2.5 mg veya Onglyza ile tedavi edilen en az 2 hastada bildirilmiştir. 5 mg) tedavinin erken kesilmesiyle ilişkili lenfopeni (sırasıyla% 0,1 ve% 0'a karşı% 0,1), döküntü (% 0,2 ve Kan kreatinin% 0.3'e karşı% 0.3 arttı (% 0'a karşı% 0.3 ve% 0) ve kan kreatin fosfokinaz arttı (% 0.1 ve% 0.2'ye karşı) 0%). Bu toplanmış analizdeki advers reaksiyonlar (araştırmacının nedensellik değerlendirmesine bakılmaksızın) Ong Ong ¥ Onglyza 5 mg ile tedavi edilen hastaların% 5'i ve plasebo ile tedavi edilen hastalardan daha yaygın olarak Tablo 1.
Tablo 1: Plasebo Kontrollü Araştırmalarda Olumsuz Reaksiyonlar (Araştırmacı Nedensellik Değerlendirmesi Olmaksızın) * Onglyza ile tedavi edilen hastaların% 5'inde 5 mg ve daha yaygın olarak tedavi edilen hastalardan daha fazla rapor edilmiştir. plasebo
| Hasta Sayısı (%) | ||
|---|---|---|
| Onglyza 5 mg N = 882 |
plasebo N = 799 |
|
| * 5 plasebo kontrollü çalışma, iki monoterapi denemesi ve aşağıdakilerin her biri ile bir ek kombinasyon terapisi denemesini içerir: metformin, tiyazolidindion veya gliburid. Tablo, glisemik kurtarmaya bakılmaksızın 24 haftalık verileri göstermektedir. | ||
| Üst solunum yolu enfeksiyonu | 68 (7.7) | 61 (7.6) |
| İdrar yolu enfeksiyonu | 60 (6.8) | 49 (6.1) |
| Baş ağrısı | 57 (6.5) | 47 (5.9) |
Onglyza 2,5 mg ile tedavi edilen hastalarda, baş ağrısı (% 6,5) plasebo ile tedavi edilen hastalara göre% 5 ¥% 5 ve daha yaygın olarak bildirilen tek advers reaksiyondu.
Bu havuzlanmış analizde, Onglyza 2.5 mg veya Onglyza 5 mg ve â and ¥% 1 ile plaseboya göre daha sık tedavi edilen hastaların
TZD çalışmasına eklentide, periferik ödem insidansı, Onglyza 5 mg için plaseboya kıyasla daha yüksekti (sırasıyla% 8.1 ve% 4.3). Onglyza 2.5 mg için periferik ödem insidansı% 3.1 idi. Periferik ödemin bildirilen advers reaksiyonlarının hiçbiri, çalışma ilacının kesilmesine neden olmamıştır. Monoterapi olarak Onglyza 2.5 mg ve Onglyza 5 mg için plaseboya karşı periferik ödem oranları% 3.6 ve% 2'ye karşı% 3 idi, % 2.1 ve% 2.1'e karşılık% 2.2 metformine eklenti terapi olarak ve% 2.4 ve% 1.2'ye karşı% 2.2'ye eklenti terapi olarak gliburitten.
Onglyza (2.5 mg, 5 mg ve 10 mg'lık birleştirilmiş analiz) ve plasebo için kırıkların insidans oranı 100 hasta yılı başına sırasıyla 1.0 ve 0.6 idi. Onglyza alan hastalarda kırık olaylarının görülme oranı zamanla artmamıştır. Nedensellik tespit edilmemiştir ve klinik dışı çalışmalar saksagliptinin kemik üzerinde olumsuz etkilerini göstermemiştir.
Klinik programda idiyopatik trombositopenik purpura tanısı ile tutarlı bir trombositopeni olayı gözlenmiştir. Bu olayın Onglyza ile olan ilişkisi bilinmemektedir.
Tip 2 Diyabetli Tedavi Naif Hastalarda Metformin ile Birlikte Uygulanan Onglyza ile İlişkili Olumsuz Tepkiler
Tablo 2, hastaların â ¥ 5% 'sinde bildirilen advers reaksiyonları (araştırmacı nedensellik değerlendirmesine bakılmaksızın) göstermektedir birlikte uygulanan Onglyza ve metformin tedavisi için naif bir ek 24 haftalık aktif kontrollü çalışmaya katılmak Hastalar.
Tablo 2: Tedaviye Naif Hastalarda Onglyza ve Metformin Kombinasyonu ile Başlangıç Tedavisi: Bildirilen Yan Etkiler (Araştırmacı Değerlendirmesinden bağımsız olarak) 5 mg Plus Metformin Kombinasyon Tedavisi ile Tedavi Edilen Hastaların% 5'inde (ve Metformin ile Tedavi Edilen Hastalara Göre Daha Sık Olarak) Tek başına)
| Hasta Sayısı (%) | ||
|---|---|---|
| Onglyza 5 mg + Metformin * N = 320 |
Metformin * N = 328 |
|
| * Metformin günde 500 mg'lık bir başlangıç dozunda başlatıldı ve günde maksimum 2000 mg'a kadar titre edildi. | ||
| Baş ağrısı | 24 (7.5) | 17 (5.2) |
| nazofarenjit | 22 (6.9) | 13 (4.0) |
hipoglisemi
Hipogliseminin advers reaksiyonları tüm hipoglisemi raporlarına dayanıyordu; eşzamanlı glikoz ölçümü gerekli değildi. Gliburid çalışmasına ek olarak, bildirilen hipoglisemi insidansı plaseboya (% 10.1) kıyasla Onglyza 2.5 mg ve Onglyza 5 mg (% 13.3 ve% 14.6) için daha yüksekti. Bu çalışmada hipoglisemi semptomları olarak tanımlanan bu çalışmada doğrulanmış hipoglisemi insidansı Parmak çubuğu glikoz değeri â ‰ ¤ 50 mg / dL, Onglyza 2.5 mg için% 2.4 ve% 0.8 ve Onglyza 5 mg ve% 0.7 için Plasebo. Monoterapi olarak verilen plaseboya karşı Onglyza 2.5 mg ve Onglyza 5 mg için bildirilen hipoglisemi insidansı% 4.0 ve% 5.6'ya kıyasla Metformin'e eklenti tedavisi olarak sırasıyla% 4,1,% 7,8 ve% 5,8; TZD. Bildirilen hipoglisemi insidansı Onglyza 5 mg artı metformin verilen tedaviye sahip hastalarda% 3.4 ve sadece metformin verilen hastalarda% 4.0 idi.
Aşırı Duyarlılık Reaksiyonları
24. haftaya kadar yapılan 5 çalışma havuzu analizinde ürtiker ve yüz ödemi gibi aşırı duyarlılıkla ilgili olaylar Onglyza 2.5 mg, Onglyza 5 mg ve plasebo alan hastaların% 1.5,% 1.5 ve% 0.4'ünde, sırasıyla. Onglyza alan hastalarda bu olayların hiçbiri hastaneye yatmayı gerektirmemiştir veya araştırmacılar tarafından hayatı tehdit ettiği bildirilmiştir. Bu havuzlanmış analizde saksagliptin ile tedavi edilen bir hasta genel ürtiker ve yüz ödemi nedeniyle kesildi.
Hayati bulgular
Onglyza ile tedavi edilen hastalarda yaşamsal belirtilerde klinik olarak anlamlı bir değişiklik gözlenmemiştir.
Laboratuvar testleri
Mutlak Lenfosit Sayımları
Onglyza ile gözlenen mutlak lenfosit sayısında doza bağlı ortalama bir azalma vardı. Bir taban çizgisinden ortalama 2200 hücre / mikroL mutlak lenfosit sayısı, ortalama yaklaşık 100 ve 120 hücre / mikroL Plaseboya göre Onglyza 5 mg ve 10 mg, 24 haftada beş plasebo kontrollü klinikte birleştirilmiş analizde gözlendi çalışmaları. Metformin ile ilk kombinasyonda sadece metformine kıyasla Onglyza 5 mg verildiğinde benzer etkiler gözlenmiştir. Plaseboya göre Onglyza 2.5 mg için fark yoktu. Lenfosit sayısı
Plaseboya göre lenfosit sayısındaki bu azalmanın klinik önemi bilinmemektedir. Klinik olarak endike olduğunda, olağandışı veya uzun süreli enfeksiyon ortamlarında olduğu gibi, lenfosit sayısı ölçülmelidir. Onglyza'nın lenfosit anormallikleri (örn., İnsan immün yetmezlik virüsü) olan hastalarda lenfosit sayıları üzerindeki etkisi bilinmemektedir.
Trombositler
Onglyza, altı, çift kör, kontrollü klinik güvenlik ve etkinlik çalışmasında trombosit sayısı üzerinde klinik olarak anlamlı veya tutarlı bir etki göstermemiştir.
üst
İlaç etkileşimleri
CYP3A4 / 5 Enzimlerinin İndükleyicileri
Rifampin, aktif metaboliti 5-hidroksi saksagliptinin zaman-konsantrasyon eğrisi (AUC) altındaki alanda değişiklik olmadan saksagliptin maruziyetini önemli ölçüde azaltmıştır. 24 saatlik bir doz aralığında plazma dipeptidil peptidaz-4 (DPP4) aktivitesinin inhibisyonu, rifampin'den etkilenmemiştir. Bu nedenle, Onglyza'nın doz ayarlaması önerilmez. [Görmek Klinik Farmakoloji, Farmakokinetik.]
CYP3A4 / 5 Enzimlerinin İnhibitörleri
CYP3A4 / 5'in Orta derecede İnhibitörleri
Diltiazem saksagliptinin maruziyetini arttırdı. Saksagliptinin plazma konsantrasyonlarında benzer artışların, diğer ılımlı CYP3A4 / 5 varlığında olması beklenmektedir. inhibitörler (örn., amprenavir, aprepitant, eritromisin, flukonazol, fosamprenavir, greyfurt suyu ve verapamil); ancak Onglyza'nın doz ayarlaması önerilmez. [Görmek Klinik Farmakoloji, Farmakokinetik.]
CYP3A4 / 5'in Güçlü İnhibitörleri
Ketokonazol, saksagliptin maruziyetini önemli ölçüde arttırdı. Saksagliptinin plazma konsantrasyonlarındaki benzer anlamlı artışların, diğer güçlü CYP3A4 / 5 inhibitörleri ile olması beklenir (ör. atazanavir, klaritromisin, indinavir, itrakonazol, nefazodon, nelfinavir, ritonavir, sakinavir ve telitromisin). Güçlü bir CYP3A4 / 5 inhibitörü ile birlikte uygulandığında Onglyza dozu 2.5 mg ile sınırlandırılmalıdır. [Görmek Dozaj ve Uygulama, Güçlü CYP3A4 / 5 İnhibitörleri ve Klinik Farmakoloji, Farmakokinetik.]
üst
Belirli Popülasyonlarda Kullanım
Gebelik
Gebelik Kategorisi B
Gebe kadınlarda yeterli ve iyi kontrollü çalışma yoktur. Hayvan üreme çalışmaları her zaman insan tepkisini öngörmediğinden, diğer antidiyabetik ilaçlar gibi Onglyza hamilelik sırasında sadece açıkça ihtiyaç duyulduğunda kullanılmalıdır.
Saxagliptin, organogenez dönemlerinde hamile sıçanlara ve tavşanlara uygulandığında test edilen hiçbir dozda teratojenik değildi. Sıçanlarda 240 mg / kg veya yaklaşık 1503 dozda pelvisin eksik kemikleşmesi, bir tür gelişimsel gecikme meydana geldi ve insanın saksagliptine ve aktif metabolite maruz kalmasının sırasıyla önerilen maksimum 5 dozda (MRHD) 66 kez maruz kalması mg. Maternal toksisite ve azalmış fetal vücut ağırlıkları, insanın MRG'de saksagliptin ve aktif metabolit için maruziyetinin sırasıyla 7986 ve 328 katında gözlenmiştir. Tavşanlardaki küçük iskelet varyasyonları, 200 mg / kg veya MRHD'nin yaklaşık 1432 ve 992 katı kadar annelik toksik bir dozda meydana geldi. Metformin ile kombinasyon halinde sıçanlara uygulandığında, saksagliptin saksagliptin MRHD'nin 21 katına maruz kalma durumunda teratojenik veya embriyoletal değildi. Metforminin daha yüksek bir saksagliptin dozu ile kombine uygulanması (saksagliptin MRHD'nin 109 katı) kraniorakşizis (kafatasının ve omurganın eksik kapanması ile karakterize nadir bir nöral tüp defekti) tek baraj. Her kombinasyondaki metformin maruziyeti, günde 2000 mg insan maruziyetinin 4 katı idi.
6. gestasyondan 20. güne kadar dişi sıçanlara uygulanan Saxagliptin, erkeklerde ve Sadece anneye toksik dozlarda dişi yavrular (1629 ve 53 kat saksagliptin ve aktif metaboliti MRHD). Herhangi bir dozda saksagliptin verilen sıçanların yavrularında fonksiyonel veya davranışsal toksisite gözlenmemiştir.
Saxagliptin hamile sıçanlarda dozlamadan sonra plasentayı fetüse geçer.
Emziren Anneler
Saxagliptin, emziren sıçanların sütünde plazma ilaç konsantrasyonları ile yaklaşık 1: 1 oranında salgılanır. Saksagliptinin anne sütüne salgılanıp salgılanmadığı bilinmemektedir. Anne sütünde birçok ilaç salgılandığı için, Onglyza emziren bir kadına uygulandığında dikkatli olunmalıdır.
Pediyatrik Kullanım
Pediatrik hastalarda Onglyza'nın güvenliği ve etkinliği belirlenmemiştir.
Geriyatrik Kullanım
Onglyza'nın altı adet çift-kör, kontrollü klinik güvenlik ve etkinlik çalışmasında 4148 randomize hastanın 634'ü (% 15,3) 65 yaş ve üzerindeydi ve 59 (% 1,4) hasta 75 yaş ve üzerindeydi. 65 yaş ve üstü hastalar ile daha genç hastalar arasında genel bir güvenlik veya etkinlik farkı gözlenmemiştir. Bu klinik deneyim, yaşlı ve genç hastalar arasındaki yanıtlardaki farklılıkları tanımlamasa da, bazı yaşlı bireylerin daha fazla duyarlılığı göz ardı edilemez.
Saxagliptin ve aktif metaboliti kısmen böbrek tarafından elimine edilir. Yaşlı hastalarda böbrek fonksiyonlarında azalma olasılığı daha yüksek olduğundan, yaşlılarda böbrek fonksiyonlarına bağlı olarak doz seçimine dikkat edilmelidir. [Görmek Dozaj ve Uygulama, Böbrek yetmezliği ve Klinik Farmakoloji, Farmakokinetik.]
üst
Doz Aşımı
Kontrollü bir klinik çalışmada, sağlıklı bireylerde 2 hafta boyunca günde 400 mg'a kadar dozlarda günde bir kez, oral olarak uygulanan Onglyza (MRHD'nin 80 katı) doza bağlı klinik advers reaksiyonlar ve QTc aralığı veya kalp üzerinde klinik olarak anlamlı bir etkisi yoktu oranı.
Doz aşımı durumunda, hastanın klinik durumu tarafından belirlendiği üzere uygun destekleyici tedaviye başlanmalıdır. Saxagliptin ve aktif metaboliti, hemodiyaliz ile giderilir (4 saat içinde dozun% 23'ü).
üst
Açıklama
Saxagliptin, DPP4 enziminin oral olarak aktif bir inhibitörüdür.
Saxagliptin monohidrat kimyasal olarak (1S, 3S, 5S) -2 - [(2S) -2-Amino-2- (3-hidroksitrikiklo [3.3.1.1)3,7] dec-1-il) asetil] -2-azabisiklo [3.1.0] heksan-3-karbonitril, monohidrat veya (1S, 3S, 5S) -2 - [(2S) -2 - Amino - 2 - (3 - hidroksiadamantan - 1 - il) asetil] - 2 - azabisiklo [3.1.0] heksan - 3 - karbonitril hidrat. Ampirik formül C'dir.18'H25N-3Ö2H2O ve molekül ağırlığı 333.43'tür. Yapısal formül:
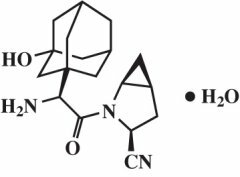
Saxagliptin monohidrat, beyaz ila açık sarı veya açık kahverengi, higroskopik olmayan, kristal bir tozdur. Suda 24 ° C ± 3 ° C'de az çözünür, etil asetatta az çözünür ve metanol, etanol, izopropil alkol, asetonitril, aseton ve polietilen glikol 400 (PEG 400) içinde çözünür.
Oral kullanım için her bir film kaplı Onglyza tableti, 2.5 mg saksagliptin veya 5.58 mg saksagliptine eşdeğer 2.79 mg saksagliptin hidroklorür (susuz) içerir. 5 mg saksagliptine eşdeğer hidroklorür (susuz) ve aşağıdaki aktif olmayan bileşenler: laktoz monohidrat, mikrokristalin selüloz, kroskarmeloz sodyum ve magnezyum stearat. Ek olarak, film kaplama aşağıdaki aktif olmayan bileşenleri içerir: polivinil alkol, polietilen glikol, titanyum dioksit, talk ve demir oksitler.
üst
Klinik Farmakoloji
Hareket mekanizması
Glukagon benzeri peptit-1 (GLP-1) ve glikoza bağımlı gibi inkretin hormonlarının artan konsantrasyonları insülinotropik polipeptit (GIP), yanıt olarak ince bağırsaktan kan dolaşımına salınır yemekler. Bu hormonlar, pankreatik beta hücrelerinden glikoza bağımlı bir şekilde insülin salınmasına neden olur, ancak dipeptidil peptidaz-4 (DPP4) enzimi tarafından dakikalar içinde inaktive edilir. GLP-1 ayrıca pankreatik alfa hücrelerinden glukagon sekresyonunu azaltır ve hepatik glikoz üretimini azaltır. Tip 2 diyabetli hastalarda GLP-1 konsantrasyonları azalır, ancak GLP-1'e insülin yanıtı korunur. Saxagliptin, inkretin hormonlarının inaktivasyonunu yavaşlatan ve böylece kan dolaşımını arttıran rekabetçi bir DPP4 inhibitörüdür. konsantrasyonları ve açlık ve postprandiyal glikoz konsantrasyonlarının tip 2 diyabetli hastalarda glikoza bağımlı bir şekilde azaltılması mellitus.
Farmakodinamik
Tip 2 diabetes mellituslu hastalarda, Onglyza uygulaması DPP4 enzim aktivitesini 24 saatlik bir süre için inhibe eder. Bir oral glikoz yükünden veya bir yemekten sonra, bu DPP4 inhibisyonu, dolaşımdaki aktif seviyelerinde 2-3 kat artışla sonuçlandı. GLP-1 ve GIP, glukagon konsantrasyonlarını azalttı ve pankreatik beta hücrelerinden glukoza bağımlı insülin sekresyonunu arttırdı. İnsülin artışı ve glukagondaki azalma, bir oral glikoz yükü veya bir yemekten sonra daha düşük açlık glikoz konsantrasyonları ve azaltılmış glikoz gezisi ile ilişkilidir.
Kardiyak Elektrofizyoloji
40 sağlıklı kişide moksifloksasin kullanan randomize, çift kör, plasebo kontrollü, 4 yollu çapraz, aktif karşılaştırıcı çalışmada, Onglyza, QTc aralığının klinik olarak anlamlı uzaması veya kalp atış hızının günlük dozlarda 40 mg'a kadar (8 kat MRHD).
Farmakokinetik
Saksagliptinin ve aktif metaboliti 5-hidroksi saksagliptinin farmakokinetiği sağlıklı kişilerde ve tip 2 diyabetes mellituslu hastalarda benzerdi. Cmaksimum ve saksagliptin ve aktif metabolitinin EAA değerleri 2.5 ila 400 mg doz aralığında orantılı olarak artmıştır. Sağlıklı deneklere 5 mg'lık tek oral bir saksagliptin dozunu takiben, saksagliptin ve aktif metaboliti için ortalama plazma EAA değerleri sırasıyla 78 ng-h / mL ve 214 ng-h / mL idi. Karşılık gelen plazma Cmaksimum değerleri sırasıyla 24 ng / mL ve 47 ng / mL idi. AUC ve C için ortalama değişkenlik (% CV)maksimum hem saxagliptin hem de aktif metaboliti için% 25'in altındaydı.
Herhangi bir doz seviyesinde günde bir kez tekrarlanan dozlama ile saksagliptinin veya aktif metabolitinin kayda değer bir birikimi gözlenmemiştir. Saksagliptinin ve aktif metabolitinin klerensinde 2.5 ila 400 mg arasında değişen dozlarda günde bir kez saksagliptin ile 14 günlük dozda doz ve zamana bağlılık gözlenmemiştir.
emme
Maksimum konsantrasyona kadar geçen ortalama süre (Tmaksimum) günde bir kez 5 mg'ı takiben, saksagliptin için 2 saat ve aktif metaboliti için 4 saat olmuştur. Yüksek yağlı bir yemekle yapılan uygulama, T'de bir artışa neden oldu.maksimum açlık koşullarına kıyasla yaklaşık 20 dakika saksagliptin. Açlık koşullarına kıyasla bir yemek verildiğinde saksagliptinin EAA'sında% 27'lik bir artış olmuştur. Onglyza yemekle birlikte veya yemeksiz olarak uygulanabilir.
dağıtım
Saksagliptinin ve aktif metabolitinin insan serumundaki in vitro protein bağlanması ihmal edilebilir. Bu nedenle, çeşitli hastalık durumlarında (örn., Böbrek veya karaciğer yetmezliği) kan proteini seviyelerindeki değişikliklerin, saksagliptinin düzenini değiştirmesi beklenmez.
Metabolizma
Saksagliptinin metabolizmasına öncelikle sitokrom P450 3A4 / 5 (CYP3A4 / 5) aracılık eder. Saksagliptinin ana metaboliti aynı zamanda saksagliptinin yarısı kadar güçlü olan bir DPP4 inhibitörüdür. Bu nedenle, güçlü CYP3A4 / 5 inhibitörleri ve indükleyicileri, saksagliptinin ve aktif metabolitinin farmakokinetiğini değiştirecektir. [Görmek İlaç etkileşimleri.]
Boşaltım
Saxagliptin, hem renal hem de hepatik yollarla elimine edilir. 50 mg'lık tek bir dozun ardından 14Dozun% 24,% 36 ve% 75'inde C-saksagliptin, idrarda sırasıyla saksagliptin, aktif metaboliti ve toplam radyoaktivite olarak atılmıştır. Saksagliptinin ortalama renal klerensi (~ 230 mL / dak), tahmini aktif glomerüler filtrasyon hızından (~ 120 mL / dak) daha yüksekti ve bazı aktif renal atılım olduğunu düşündürdü. Uygulanan radyoaktivitenin toplam% 22'si, safra ve / veya emilmemiş ilaçtan gastrointestinal sistemden atılan saksagliptin dozunun kısmını temsil eden dışkıda geri kazanıldı. Sağlıklı deneklere tek bir oral 5 mg Onglyza dozunun ardından ortalama plazma terminal yarılanma ömrü (t1/2), saksagliptin ve aktif metaboliti için sırasıyla 2.5 ve 3.1 saat idi.
Belirli Popülasyonlar
Böbrek yetmezliği
Saksagliptinin farmakokinetiğini (10 mg doz) değerlendirmek için tek doz, açık etiketli bir çalışma yapılmıştır. Kronik böbrek yetmezliği olan hastalar (grup başına N = 8) normal böbrek hastalarına kıyasla işlevi. Çalışmaya, kreatinin klerensi bazında hafif (> 50 ila <80) şeklinde sınıflandırılmış böbrek yetmezliği olan hastalar dahil edildi. mL / dak), orta (30 ila <50 mL / dak) ve şiddetli (<30 mL / dak) ve ayrıca son dönem böbrek yetmezliği olan hastalar hemodiyaliz. Kreatinin klerensi, Cockcroft-Gault formülüne dayanan serum kreatinininden tahmin edildi:
CrCl = [140 ”yaş (yıl)] weight— ağırlık (kg) {kadın hastalar için × 0.85}
[72 Ã - serum kreatinin (mg / dL)]
Böbrek yetmezliğinin derecesi C'yi etkilemedimaksimum saksagliptin veya aktif metaboliti. Hafif böbrek yetmezliği olan hastalarda, saksagliptinin ve aktif metabolitinin EAA değerleri, normal böbrek fonksiyonu olan kişilerde EAA değerlerine göre sırasıyla% 20 ve% 70 daha yüksektir. Bu büyüklükteki artışların klinik olarak anlamlı olmadığı düşünüldüğü için, hafif böbrek yetmezliği olan hastalarda doz ayarlaması önerilmez. Orta veya şiddetli böbrek yetmezliği olan hastalarda, saksagliptinin ve aktif maddesinin AUC değerleri metabolit normal böbrek hastalarında EAA değerlerine göre sırasıyla 2.1 ve 4.5 kat daha yüksekti işlevi. Normal böbrek fonksiyonu olan hastalardakine benzer saksagliptin ve aktif metabolitinin plazma maruziyetini sağlamak için önerilen doz orta ve şiddetli böbrek yetmezliği olan hastalarda ve son dönem böbrek yetmezliği gerektiren hastalarda günde 2.5 mg'dır. hemodiyaliz. Saxagliptin hemodiyaliz ile uzaklaştırılır.
Karaciğer yetmezliği
Karaciğer yetmezliği olan hastalarda (Child-Pugh sınıfları A, B ve C), ortalama Cmaksimum ve saksagliptinin EAA değeri, 10 mg'lık tek bir saksagliptin dozunun uygulanmasını takiben sağlıklı eşleşen kontrollere kıyasla, sırasıyla% 8 ve% 77'ye kadar daha yüksekti. Karşılık gelen Cmaksimum aktif metabolitin EAA değeri, sağlıklı eşleştirilmiş kontrollere kıyasla, sırasıyla% 59 ve% 33'e kadar daha düşüktü. Bu farklılıkların klinik olarak anlamlı olduğu düşünülmemektedir. Karaciğer yetmezliği olan hastalarda doz ayarlaması önerilmez.
Vücut kitle indeksi
Önemli olarak tanımlanmayan vücut kitle indeksine (BMI) göre herhangi bir doz ayarlaması önerilmemektedir popülasyon farmakokinetiğinde saksagliptinin veya aktif metabolitinin görünür klirensine eşdeğer analizi.
Cinsiyet
Cinsiyete göre herhangi bir doz ayarlaması önerilmemektedir. Saksagliptin farmakokinetiğinde erkekler ve kadınlar arasında fark yoktu. Erkeklerle karşılaştırıldığında, dişiler aktif metabolit için erkeklerden yaklaşık% 25 daha yüksek maruziyet değerlerine sahiptir, ancak bu farkın klinik açıdan anlamlı olması muhtemel değildir. Toplumsal cinsiyet farmakokinetik analizde saksagliptinin ve aktif metabolitinin görünür klirensi üzerinde anlamlı bir eş değişken olarak tanımlanmamıştır.
yaşlı
Sadece yaşa göre herhangi bir doz ayarlaması önerilmemektedir. Yaşlı denekler (65-80 yaş)% 23 ve% 59 daha yüksek geometrik ortalama C'ye sahiptimaksimum ve saksagliptin için sırasıyla genç deneklere (18-40 yaş) göre geometrik ortalama EAA değerleri. Yaşlı ve genç denekler arasındaki aktif metabolit farmakokinetiğindeki farklılıklar genellikle saksagliptin farmakokinetiğinde gözlenen farklılıkları yansıtmaktadır. Genç ve yaşlılarda saksagliptin ve aktif metabolit farmakokinetiği arasındaki fark deneklerin, böbrek fonksiyonlarının düşmesi ve metabolik kapasite ile birlikte artan yaş. Nüfus farmakokinetik analizinde saksagliptinin ve aktif metabolitinin görünür klirensinde yaş anlamlı bir eş değişken olarak tanımlanmadı
pediatrik
Pediyatrik hastalarda saksagliptinin farmakokinetiğini karakterize eden çalışmalar yapılmamıştır.
Irk ve etnik köken
Yarışa göre doz ayarlaması önerilmez. Popülasyon farmakokinetik analizi, saksagliptinin ve aktifinin farmakokinetiğini karşılaştırdı 105 Kafkas dışı denek içeren 309 Kafkas denekte metabolit (altı ırktan oluşur) grupları içerir). Bu iki popülasyon arasında saksagliptinin ve aktif metabolitinin farmakokinetiğinde anlamlı bir fark saptanmamıştır.
İlaç-İlaç Etkileşimleri
İlaç Etkileşimlerinin İn vitro Değerlendirilmesi
Saksagliptinin metabolizmasına öncelikle CYP3A4 / 5 aracılık eder.
İn vitro çalışmalarda, saksagliptin ve aktif metaboliti CYP1A2, 2A6, 2B6, 2C9, 2C19, 2D6, 2E1 veya 3A4'ü inhibe etmedi veya CYP1A2, 2B6, 2C9 veya 3A4'ü indüklemedi. Bu nedenle, saksagliptinin bu enzimler tarafından metabolize edilen birlikte uygulanan ilaçların metabolik klerensini değiştirmesi beklenmez. Saxagliptin bir P-glikoprotein (P-gp) substratıdır, ancak P-gp'nin önemli bir inhibitörü veya indükleyicisi değildir.
Saksagliptinin ve aktif metabolitinin insan serumundaki in vitro protein bağlanması ihmal edilebilir. Bu nedenle, protein bağlanmasının saksagliptin veya diğer ilaçların farmakokinetiği üzerinde anlamlı bir etkisi olmayacaktır.
İlaç Etkileşimlerinin İn Vivo Değerlendirilmesi
Saxagliptin'in Diğer İlaçlar Üzerine Etkileri
Sağlıklı deneklerde aşağıda tarif edildiği gibi yapılan çalışmalarda, saksagliptin metformin, gliburid, pioglitazon, digoksin, simvastatin, diltiazem veya ketokonazolün farmakokinetiği.
Metformin: Tek bir saksagliptin (100 mg) ve bir hOCT-2 substratı olan metforminin (1000 mg) birlikte uygulanması, sağlıklı bireylerde metforminin farmakokinetiğini değiştirmedi. Bu nedenle Onglyza, hOCT-2 aracılı taşınmanın bir inhibitörü değildir.
Glyburide: Bir CYP2C9 substratı olan tek bir saksagliptin (10 mg) ve gliburidin (5 mg) birlikte uygulanması plazma C'yi arttırdımaksimum % 16 oranında gliburit; bununla birlikte gliburitin EAA değeri değişmedi. Bu nedenle Onglyza, CYP2C9 aracılı metabolizmayı anlamlı bir şekilde inhibe etmez.
Pioglitazon: CYP2C8 substratı olan günde bir defaya mahsus saksagliptin (10 mg) ve pioglitazon (45 mg) dozlarının birlikte uygulanması plazma C'yi arttırdımaksimum % 14 oranında pioglitazon; bununla birlikte pioglitazonun EAA değeri değişmedi.
Digoksin: P-gp substratı olan günde bir defaya mahsus saksagliptin (10 mg) ve digoksinin (0.25 mg) birlikte uygulanması digoksinin farmakokinetiğini değiştirmedi. Bu nedenle Onglyza, P-gp aracılı taşınmanın bir inhibitörü veya indükleyicisi değildir.
Simvastatin: Bir CYP3A4 / 5 substratı olan günde bir defaya mahsus saksagliptin (10 mg) ve simvastatinin (40 mg) birlikte uygulanması simvastatinin farmakokinetiğini değiştirmedi. Bu nedenle Onglyza, CYP3A4 / 5 aracılı metabolizmanın bir inhibitörü veya indükleyicisi değildir.
Diltiazem: CYP3A4 / 5'in orta derecede inhibitörü olan günde bir kez birden fazla saksagliptin (10 mg) ve diltiazem (sabit durumda 360 mg uzun etkili formülasyon) birlikte uygulanması, plazma C'yi arttırdı.maksimum % 16 oranında diltiazem; bununla birlikte diltiazem'in EAA değeri değişmedi.
Ketokonazol: Tek doz saksagliptin (100 mg) ve çoklu doz ketokonazolün (her 12 saatte bir 200 mg) birlikte uygulanması kararlı durum), CYP3A4 / 5 ve P-gp'nin güçlü bir inhibitörü, ketokonazolün plazma Cmax ve AUC'sini% 16 ve% 13 azalttı, sırasıyla.
Diğer İlaçların Saxagliptin Üzerine Etkileri
Metformin: Bir tek saksagliptin (100 mg) ve bir hOCT-2 substratı olan metforminin (1000 mg) birlikte uygulanması, C'yi azalttımaksimum saksagliptinin% 21; ancak AUC değişmedi.
Glyburide: Bir CYP2C9 substratı olan tek doz saksagliptin (10 mg) ve gliburidin (5 mg) birlikte uygulanması, C'yi arttırdı.maksimum saksagliptinin% 8'i; bununla birlikte, saksagliptinin EAA değeri değişmemiştir.
Pioglitazon: Birden fazla günde bir kez saksagliptin (10 mg) ve pioglitazon dozlarının birlikte uygulanması (45 mg), bir CYP2C8 (ana) ve CYP3A4 (küçük) substratı, farmakokinetiğini değiştirmedi saksagliptin.
Digoksin: P-gp substratı olan günde bir defada birden fazla saksagliptin (10 mg) ve digoksinin (0.25 mg) birlikte uygulanması, saksagliptinin farmakokinetiğini değiştirmemiştir.
Simvastatin: Birden fazla günde bir kez saksagliptin (10 mg) ve bir CYP3A4 / 5 substratı olan simvastatinin (40 mg) birlikte uygulanması, C'yi arttırdı.maksimum saksagliptinin% 21; bununla birlikte, saksagliptinin EAA değeri değişmemiştir.
Diltiazem: CYP3A4 / 5'in orta bir inhibitörü olan tek bir saksagliptin (10 mg) ve diltiazem (kararlı durumda 360 mg uzun etkili formülasyon) birlikte uygulanması, C'yi arttırdı.maksimum saksagliptin% 63 ve EAA değeri 2.1 kat artmıştır. Bu, C'de karşılık gelen bir azalma ile ilişkilendirildi.maksimum ve aktif metabolitin EAA değeri sırasıyla% 44 ve% 36'dır.
Ketokonazol: CYP3A4 / 5 ve P-gp'nin güçlü bir inhibitörü olan tek bir saksagliptin (100 mg) ve ketokonazolün (kararlı durumda her 12 saatte bir 200 mg) birlikte uygulanması, C'yi arttırdı.maksimum saksagliptin için% 62 ve EAA için 2.5 kat. Bu, C'de karşılık gelen bir azalma ile ilişkilendirildi.maksimum ve aktif metabolitin EAA değeri sırasıyla% 95 ve% 91'dir.
Başka bir çalışmada, tek bir saksagliptin (20 mg) ve ketokonazolün (sabit durumda her 12 saatte bir 200 mg) birlikte uygulanması, C'yi arttırdı.maksimum ve saksagliptinin EAA değeri sırasıyla 2.4 kat ve 3.7 kat artmıştır. Bu, C'de karşılık gelen bir azalma ile ilişkilendirildi.maksimum ve aktif metabolitin EAA değeri sırasıyla% 96 ve% 90'dır.
Rifampin: Tek doz saksagliptin (5 mg) ve rifampin (sabit durumda 600 mg QD) birlikte uygulanması C'yi azalttımaksimum ve saksagliptinin EAA değeri sırasıyla% 53 ve% 76 oranında Cmaksimum (% 39) ancak aktif metabolitin plazma EAA'sında önemli bir değişiklik yoktur.
Omeprazol: Bir CYP2C19, günde bir kez birden fazla saksagliptin (10 mg) ve omeprazolün (40 mg) birlikte uygulanması (majör) ve CYP2C19 inhibitörü ve MRP-3'ün bir indükleyicisi olan CYP3A4 substratı, farmakokinetiğini değiştirmedi saksagliptin.
Alüminyum hidroksit + magnezyum hidroksit + simetikon: Tek doz saksagliptin (10 mg) ve bir dozun birlikte uygulanması alüminyum hidroksit (2400 mg), magnezyum hidroksit (2400 mg) ve simetikon (240 mg) içeren sıvı C'yi azalttımaksimum saksagliptinin% 26; bununla birlikte, saksagliptinin EAA değeri değişmemiştir.
Famotidin: Bir hOCT-1, hOCT-2 ve hOCT-3 inhibitörü olan tek bir famotidin dozundan (40 mg) 3 saat sonra tek bir saksagliptin (10 mg) dozunun uygulanması, C'yi arttırdı.maksimum saksagliptin% 14; bununla birlikte, saksagliptinin EAA değeri değişmemiştir.
üst
Klinik Olmayan Toksikoloji
Karsinogenez, Mutajenez, Doğurganlık Bozukluğu
Saxagliptin, değerlendirilen en yüksek dozlarda farelerde (50, 250 ve 600 mg / kg) veya sıçanlarda (25, 75, 150 ve 300 mg / kg) tümör oluşturmadı. Farelerde değerlendirilen en yüksek dozlar, 5 mg / gün MRHD'de insan maruziyetinin yaklaşık 870 (erkek) ve 1165 (dişi) katına eşittir. Sıçanlarda maruziyet MRHD'nin yaklaşık 355 (erkek) ve 2217 (kadın) katıydı.
Saxagliptin, primer insanda in vitro bir sitogenetik analizi olan bir in vitro Ames bakteriyel testinde metabolik aktivasyonlu veya metabolik olmayan veya slastojenik değildi lenfositler, sıçanlarda in vivo oral mikronükleus analizi, sıçanlarda in vivo oral DNA onarım çalışması ve sıçan periferik kanında oral in vivo / in vitro sitogenetik çalışması lenfositler. Aktif metabolit, bir in vitro Ames bakteriyel analizinde mutajenik değildi.
Bir sıçan fertilite çalışmasında, erkekler çiftleşme öncesinde, çiftleşme sırasında ve planlanana kadar 2 hafta boyunca oral gavaj dozları ile tedavi edildi. sonlandırma (toplamda yaklaşık 4 hafta) ve dişiler, gebelikten çiftleşmeden önce 2 hafta boyunca oral gavaj dozlarıyla tedavi edildi. 7. gün. MRHD'nin yaklaşık 603 (erkek) ve 776 (kadın) maruziyetinde doğurganlık üzerinde hiçbir olumsuz etki gözlenmemiştir. Maternal toksisiteyi ortaya çıkaran daha yüksek dozlar da fetal rezorpsiyonları arttırdı (MRHD'nin yaklaşık 2069 ve 6138 katı). Östrojen döngüsü, doğurganlık, yumurtlama ve implantasyon üzerindeki ek etkiler MRHD'nin yaklaşık 6138 katında gözlenmiştir.
Hayvan Toksikolojisi
Saxagliptin, sinomolgus maymunlarının ekstremitelerinde (cilt, kuyruk, basamak, skrotum ve / veya burun yaraları ve / veya ülserleşmesi) olumsuz cilt değişiklikleri üretti. Deri lezyonları MRHD'nin 20 katında geri dönüşümlüdür, ancak bazı durumlarda daha yüksek maruziyetlerde geri dönüşümsüz ve nekrotizan olmuştur. 5 mg MRHD'ye (1 ila 3 kez) benzer maruziyetlerde ters cilt değişiklikleri gözlenmedi. İnsanlarda saksagliptinin klinik çalışmalarında maymunlarda cilt lezyonları ile klinik korelasyon gözlenmemiştir.
üst
Klinik çalışmalar
Onglyza, monoterapi olarak ve metformin, gliburid ve tiazolidindion (pioglitazon ve rosiglitazon) terapisi ile kombinasyon halinde çalışılmıştır. Onglyza, insülin ile kombinasyon halinde çalışılmamıştır.
Tiply diabetes mellituslu toplam 4148 hasta, Onglyza'nın güvenliğini ve glisemik etkinliğini değerlendirmek için yapılan altı adet çift-kör, kontrollü klinik çalışmada randomize edilmiştir. Bu çalışmalardaki toplam 3021 hasta Onglyza ile tedavi edildi. Bu çalışmalarda ortalama yaş 54'tür ve hastaların% 71'i Kafkas,% 16'sı Asya,% 4'ü siyahtır ve% 9'u diğer ırk gruplarındandır. Onglyza alan 315'i içeren 423 hasta, 6 ila 12 haftalık plasebo kontrollü, doz aralıklı bir çalışmaya katıldı.
Bu altı çift-kör çalışmada Onglyza günde bir kez 2.5 mg ve 5 mg'lık dozlarda değerlendirildi. Bu çalışmaların üçü ayrıca günde 10 mg saksagliptin dozunu değerlendirdi. Günlük 10 mg saksagliptin dozu, 5 mg günlük dozdan daha fazla etkinlik sağlamadı. Hemoglobin A1c (A1C) 'de klinik olarak anlamlı ve istatistiksel olarak anlamlı iyileşmeler üretilen tüm dozlarda Onglyza ile tedavi, standart bir oral glukoz tolerans testi (OGTT) sonrasında açlık plazma glikozu (FPG) ve 2 saatlik postprandiyal glikoz (PPG) kontrol. A1C'de azalma cinsiyet, yaş, ırk ve başlangıç BMI dahil olmak üzere alt gruplarda görülmüştür.
Onglyza, plaseboya kıyasla vücut ağırlığındaki başlangıçtan veya açlık serum lipitlerinden önemli değişikliklerle ilişkili değildi.
monoterapi
Tip 2 diyabetli toplam 766 hasta diyet ve egzersiz üzerinde yetersiz kontrol edilmiştir (A1C â ‰ ¥% 7 ila â ‰ ¤10) Onglyza'nın etkinliğini ve güvenliğini değerlendiren 24 haftalık, çift kör, plasebo kontrollü iki çalışmaya katıldı monoterapi.
İlk denemede, 2 haftalık tek kör diyet, egzersiz ve plasebo giriş periyodunu takiben 401 hasta 2.5 mg, 5 mg veya 10 mg Onglyza veya plaseboya randomize edildi. Çalışma sırasında spesifik glisemik hedeflere ulaşamayan hastalar, metformin kurtarma tedavisi ile tedavi edildi, plasebo veya Onglyza'ya eklendi. Etkilenme, kurtarmaya ihtiyaç duyan hastalar için kurtarma terapisi öncesinde son ölçümde değerlendirildi. Onglyza'nın doz titrasyonuna izin verilmedi.
Günde 2.5 mg ve 5 mg Onglyza ile tedavi, A1C, FPG ve PPG'de plaseboya kıyasla önemli gelişmeler sağlamıştır (Tablo 3). Glisemik kontrol eksikliği nedeniyle tedaviyi bırakan veya önceden belirlenen toplantı için kurtarılan hastaların yüzdesi glisemik kriterler Onglyza 2.5 mg tedavi grubunda% 16, Onglyza 5 mg tedavi grubunda% 20 ve plasebo grubu.
Tablo 3: Tip 2 Diyabetli Hastalarda Onglyza Monoterapisinin Plasebo Kontrollü Bir Çalışmasında 24. Haftada Glisemik Parametreler *
| Etkinlik Parametresi | ONGLYZA 2.5 mg N = 102 |
ONGLYZA 5 mg N = 106 |
plasebo N = 95 |
|---|---|---|---|
| * Kurtarmaya ihtiyaç duyan hastalar için metformin kurtarma terapisi öncesinde çalışmadaki son gözlemi veya son gözlemi kullanarak tedavi etme niyeti. | |||
| †En küçük kareler, taban çizgisi değeri için ayarlanmış ortalama anlamına gelir. | |||
| c Plaseboya kıyasla p değeri <0.0001 | |||
| § Plaseboya kıyasla p değeri <0.05 | |||
| ¶ Önemi, 2.5 mg Onglyza dozu için 2 saatlik PPG için test edilmedi. | |||
| Hemoglobin A1C (%) | N = 100 | N = 103 | N = 92 |
| Temel (ortalama) | 7.9 | 8.0 | 7.9 |
| Taban çizgisinden değişim (ayarlanmış ortalama†) | −0.4 | −0.5 | +0.2 |
| Plasebodan fark (ayarlanmış ortalama†) | −0.6c | −0.6c | |
| % 95 Güven Aralığı | (−0.9, −0.3) | (−0.9, −0.4) | |
| A1C'ye ulaşan hastaların yüzdesi | 35% (35/100) | 38% §(39/103) | 24% (22/92) |
| Açlık Plazma Glikozu (mg / dL) | N = 101 | N = 105 | N = 92 |
| Temel (ortalama) | 178 | 171 | 172 |
| Taban çizgisinden değişim (ayarlanmış ortalama†) | −15 | −9 | +6 |
| Plasebodan fark (ayarlanmış ortalama†) | −21 § | −15 § | |
| % 95 Güven Aralığı | (−31, −10) | (−25, −4) | |
| 2 saatlik Postprandiyal Glikoz (mg / dL) | N = 78 | N = 84 | N = 71 |
| Temel (ortalama) | 279 | 278 | 283 |
| Taban çizgisinden değişim (ayarlanmış ortalama†) | −45 | −43 | −6 |
| Plasebodan fark (ayarlanmış ortalama†) | −39 ¶ | −37 § | |
| % 95 Güven Aralığı | (−61, −16) | (−59, −15) |
Onglyza için bir dizi doz rejimini değerlendirmek için ikinci bir 24 haftalık monoterapi denemesi gerçekleştirildi. Tedavisi yetersiz diyabetli hastalar (A1C -% 7 -% ~ 10) 2 haftalık, tek-kör diyet, egzersiz ve plasebo giriş periyodu geçirdi. Toplam 365 hasta her sabah 2.5 mg, her sabah 5 mg, her sabah 5 mg'a kadar olası titrasyonla 2.5 mg veya Onglyza'nın her akşamı 5 mg veya plasebo olarak randomize edildi. Çalışma sırasında spesifik glisemik hedeflere ulaşamayan hastalar, plasebo veya Onglyza'ya eklenen metformin kurtarma tedavisi ile tedavi edildi; tedavi grubu başına randomize edilen hasta sayısı 71-74 arasında değişmektedir.
Her sabah Onglyza 5 mg veya her akşam 5 mg ile tedavi, A1C'de plaseboya kıyasla önemli iyileşmeler sağladı (sırasıyla plasebo düzeltmeli ortalama â''0.4 ve ˆˆ0.3% azalma). Her sabah 2.5 mg Onglyza ile tedavi, A1C'de plaseboya göre önemli bir iyileşme sağladı (ortalama plasebo düzeltmeli â''.4.4 azalma).
Birden fazla tedavinin bir arada uygulanması
Metformin ile Ek Kombinasyon Tedavisi
Tipik diyabetli toplam 743 hasta bu 24 haftalık, randomize, çift kör, plasebo kontrollü çalışmaya katılmıştır. metformin üzerinde yetersiz glisemik kontrolü (A1C â ‰ ¥% 7 ve â ‰ ¤10) olan hastalarda metformin ile kombinasyon halinde Onglyza'nın etkinliği ve güvenliği tek başına. Kayıt için hak kazanmak için, hastaların en az 8 hafta boyunca stabil bir metformin dozunda (günde 1500-2550 mg) olması gerekiyordu.
Uygunluk kriterlerini karşılayan hastalar tek kör, 2 haftalık, diyet ve egzersiz plasebo girişine alındı hastaların çalışma öncesi dozlarında günde 2500 mg'a kadar metformin aldığı süre ders çalışma. Giriş dönemini takiben, uygun hastalar mevcut açık etiketli metformin dozuna ek olarak 2.5 mg, 5 mg veya 10 mg Onglyza veya plasebo'ya randomize edildi. Çalışma sırasında spesifik glisemik hedeflere ulaşamayan hastalar, mevcut çalışma ilaçlarına eklenen pioglitazon kurtarma tedavisi ile tedavi edildi. Onglyza ve metformin doz titrasyonlarına izin verilmemiştir.
Meformine Onglyza 2.5 mg ve 5 mg eklentisi, metformine plasebo eklentisine kıyasla A1C, FPG ve PPG'de önemli gelişmeler sağlamıştır (Tablo 4). A1C için taban çizgisinden zaman içinde ve bitiş noktasında ortalama değişiklikler Şekil 1'de gösterilmiştir. Glisemik kontrol eksikliği nedeniyle kesilen veya önceden belirlenmiş glisemik kriterleri karşıladığı için kurtarılan hastaların oranı% 15 idi Onglyza metformin grubuna 2,5 mg eklenti, metformin grubuna Onglyza 5 mg eklentisi% 13 ve metformin plasebo eklentisinde% 27 grubudur.
Tablo 4: Metformin ile Ek Kombinasyon Tedavisi Olarak Onglyza'nın Plasebo Kontrollü Bir Çalışmasında 24. Haftada Glisemik Parametreler *
| Etkinlik Parametresi | Onglyza 2.5 mg + Metformin N = 192 |
Onglyza 5 mg + Metformin N = 191 |
plasebo + Metformin N = 179 |
|---|---|---|---|
| * Kurtarmaya ihtiyaç duyan hastalar için pioglitazon kurtarma terapisi öncesinde çalışma üzerinde son gözlem veya son gözlem kullanarak tedavi etme niyeti. | |||
| †En küçük kareler, taban çizgisi değeri için ayarlanmış ortalama anlamına gelir. | |||
| c Plasebo + metformine kıyasla p değeri <0.0001 | |||
| § Plasebo + metformine kıyasla p değeri <0.05 | |||
| Hemoglobin A1C (%) | N = 186 | N = 186 | N = 175 |
| Temel (ortalama) | 8.1 | 8.1 | 8.1 |
| Taban çizgisinden değişim (ayarlanmış ortalama†) | −0.6 | −0.7 | +0.1 |
| Plasebodan fark (ayarlanmış ortalama†) | −0.7c | −0.8c | |
| % 95 Güven Aralığı | (−0.9, −0.5) | (−1.0, −0.6) | |
| A1C'ye ulaşan hastaların yüzdesi | 37% §(69/186) | 44% §(81/186) | 17% (29/175) |
| Açlık Plazma Glikozu (mg / dL) | N = 188 | N = 187 | N = 176 |
| Temel (ortalama) | 174 | 179 | 175 |
| Taban çizgisinden değişim (ayarlanmış ortalama†) | −14 | −22 | +1 |
| Plasebodan fark (ayarlanmış ortalama†) | −16 § | −23 § | |
| % 95 Güven Aralığı | (−23, −9) | (−30, −16) | |
| 2 saatlik Postprandiyal Glikoz (mg / dL) | N = 155 | N = 155 | N = 135 |
| Temel (ortalama) | 294 | 296 | 295 |
| Taban çizgisinden değişim (ayarlanmış ortalama†) | −62 | −58 | −18 |
| Plasebodan fark (ayarlanmış ortalama†) | −44 § | −40 § | |
| % 95 Güven Aralığı | (−60, −27) | (−56, −24) |
Şekil 1: Metformin ile Eklenti Kombinasyon Tedavisi Olarak Onglyza'nın Plasebo Kontrollü Bir Denemesinde A1C'deki Taban Çizgisinden Ortalama Değişim *
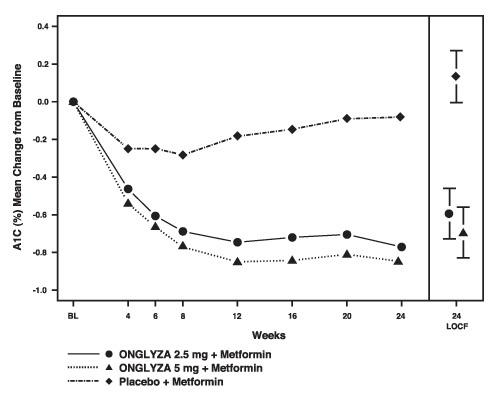
* Başlangıç ve hafta 24 değeri olan hastaları içerir.
24. Hafta (LOCF), kurtarmaya ihtiyaç duyan hastalar için pioglitazon kurtarma terapisi öncesinde yapılan çalışmadaki son gözlemi kullanan tedavi etme popülasyonunu içerir. Taban çizgisinden ortalama değişim, taban çizgisi değeri için ayarlanır.
Tiazolidindion ile Ek Kombinasyon Tedavisi
Tip 2 diyabetli toplam 565 hasta bu 24 haftalık, randomize, çift kör, plasebo kontrollü çalışmaya katılmıştır. glisemik kontrolü yetersiz olan hastalarda (A1C â ‰ ¥% 7 ila â 10 ¤% 10,5) tiyazolidindion (TZD) ile kombinasyon halinde Onglyza'nın etkinliği ve güvenliği Sadece TZD. Kayıt için hak kazanmak için, hastaların kararlı bir pioglitazon dozunda olması gerekiyordu (günde bir kez 30-45 mg). veya rosiglitazon (günde bir kez 4 mg veya günde bir kez veya 4 mg'lık iki bölünmüş dozda 8 mg) en az 12 haftalar.
Uygunluk kriterlerini karşılayan hastalar tek kör, 2 haftalık, diyet ve egzersize alındı Hastaların çalışma öncesi dozlarında TZD aldıkları plasebo giriş süresi ders çalışma. Giriş dönemini takiben uygun hastalar, mevcut TZD dozlarına ek olarak 2.5 mg veya 5 mg Onglyza veya plasebo'ya randomize edildi. Çalışma sırasında spesifik glisemik hedeflere ulaşamayan hastalar metformin kurtarma ile tedavi edildi ve mevcut çalışma ilaçlarına eklendi. Çalışma sırasında Onglyza veya TZD'nin doz titrasyonuna izin verilmemiştir. TZD rejiminde, tıbbi olarak uygun olduğuna inanılırsa, araştırmacının inisiyatifinde belirtilen eşdeğer terapötik dozlarda rosiglitazondan pioglitazona bir değişikliğe izin verilmiştir.
Onglyza TZD'ye 2.5 mg ve 5 mg eklenti, TZD'ye plasebo eklentisine kıyasla A1C, FPG ve PPG'de önemli gelişmeler sağlamıştır (Tablo 5). Glisemik kontrol eksikliği nedeniyle kesilen veya önceden belirlenmiş glisemik kriterlerini karşıladığı için kurtarılan hastaların oranı TZD grubuna Onglyza 2.5 mg eklentisinde% 10, TZD grubuna Onglyza 5 mg eklentisinde% 6 ve TZD grubuna plasebo eklentisinde% 10 olmuştur grubudur.
Tablo 5: Tiazolidindion ile Ek Kombinasyon Tedavisi Olarak Onglyza'nın Plasebo Kontrollü Bir Çalışmasında 24. Haftada Glisemik Parametreler *
| Etkinlik Parametresi | Onglyza 2.5 mg + TZD N = 195 |
Onglyza 5 mg + TZD N = 186 |
plasebo + TZD N = 184 |
|---|---|---|---|
| * Kurtarmaya ihtiyaç duyan hastalar için metformin kurtarma terapisi öncesinde çalışmadaki son gözlemi veya son gözlemi kullanarak tedavi etme niyeti. | |||
| †En küçük kareler, taban çizgisi değeri için ayarlanmış ortalama anlamına gelir. | |||
| c Plasebo + TZD'ye kıyasla p değeri <0.0001 | |||
| § Plasebo + TZD ile karşılaştırıldığında p değeri <0.05 | |||
| Hemoglobin A1C (%) | N = 192 | N = 183 | N = 180 |
| Temel (ortalama) | 8.3 | 8.4 | 8.2 |
| Taban çizgisinden değişim (ayarlanmış ortalama†) | −0.7 | −0.9 | −0.3 |
| Plasebodan fark (ayarlanmış ortalama†) | −0.4 § | −0.6c | |
| % 95 Güven Aralığı | (−0.6, −0.2) | (−0.8, −0.4) | |
| A1C'ye ulaşan hastaların yüzdesi | 42% §(81/192) | 42% §(77/184) | 26% (46/180) |
| Açlık Plazma Glikozu (mg / dL) | N = 193 | N = 185 | N = 181 |
| Temel (ortalama) | 163 | 160 | 162 |
| Taban çizgisinden değişim (ayarlanmış ortalama†) | −14 | −17 | −3 |
| Plasebodan fark (ayarlanmış ortalama†) | −12 § | −15 § | |
| % 95 Güven Aralığı | (−20, −3) | (−23, −6) | |
| 2 saatlik Postprandiyal Glikoz (mg / dL) | N = 156 | N = 134 | N = 127 |
| Temel (ortalama) | 296 | 303 | 291 |
| Taban çizgisinden değişim (ayarlanmış ortalama†) | −55 | −65 | −15 |
| Plasebodan fark (ayarlanmış ortalama†) | −40 § | −50 § | |
| % 95 Güven Aralığı | (−56, −24) | (−66, −34) |
Glyburide ile Ek Kombinasyon Tedavisi
Etkililiği ve güvenliği değerlendirmek için bu 24 haftalık, randomize, çift kör, plasebo kontrollü çalışmaya tip 2 diyabetli toplam 768 hasta katıldı submaksimal SU dozunda kayıtta yetersiz glisemik kontrolü olan hastalarda (A1C â ‰ ¥% 7.5 ila â ‰ ¤10) Onglyza'nın bir sülfonilüre (SU) ile kombinasyonu tek başına. Kayıt için hak kazanmak için, hastaların 2 ay veya daha uzun süre submaksimal bir SU dozunda olması gerekti. Bu çalışmada, Onglyza, sabit, ara bir SU dozu ile kombinasyon halinde, daha yüksek bir SU dozu ile titrasyon ile karşılaştırılmıştır.
Uygunluk kriterlerini karşılayan hastalar tek kör, 4 haftalık, diyet ve egzersiz giriş periyoduna alındı ve günde bir kez 7.5 mg gliburide konuldu. Giriş dönemini takiben, A1C â ‰ ¥% 7 ila â ‰ ¤10 olan uygun hastalar herhangi bir 2.5'e randomize edildi. 7.5 mg gliburide veya plaseboya mg veya 5 mg Onglyza eklentisi ve toplam 10 mg günlük günlük doz gliburitten. Plasebo alan hastalar, toplam günlük 15 mg dozuna kadar gliburid titre edilebildi. Onglyza 2.5 mg veya 5 mg alan hastalarda gliburidin yukarı titrasyonuna izin verilmemiştir. Gliburid, araştırmacı tarafından gerekli görülen hipoglisemi nedeniyle 24 haftalık çalışma döneminde herhangi bir tedavi grubunda bir kez düşük titre edilebilir. Plasebo artı gliburid grubundaki hastaların yaklaşık% 92'si, çalışma döneminin ilk 4 haftası boyunca toplam 15 mg'lık nihai toplam doza kadar titre edilmiştir. Çalışma sırasında spesifik glisemik hedeflere ulaşamayan hastalar metformin kurtarma ile tedavi edildi ve mevcut çalışma ilacına eklendi. Çalışma sırasında Onglyza'nın doz titrasyonuna izin verilmedi.
Gliburit ile kombinasyon halinde, Onglyza 2.5 mg ve 5 mg, plasebo artı yukarı titre edilmiş gliburit grubuna kıyasla A1C, FPG ve PPG'de önemli gelişmeler sağlamıştır (Tablo 6). Glisemik kontrol eksikliği nedeniyle tedaviyi bırakan veya önceden belirlenmiş glisemik kriterleri karşılamak için kurtarılan hastaların oranı% 18 idi. Onglyza 2.5 mg gliburid grubuna eklenti, Onglyza 5 mg gliburid grubuna eklenti% 17 ve plasebo artı yukarı titreli gliburit grubudur.
Tablo 6: Glyburide ile Ek Kombinasyon Tedavisi Olarak Onglyza'nın Plasebo Kontrollü Bir Çalışmasında 24. Haftada Glisemik Parametreler *
| Etkinlik Parametresi | ONGLYZA 2.5 mg + Gliburid'in 7.5 mg N = 248 |
ONGLYZA 5 mg + Gliburid'in 7.5 mg N = 253 |
plasebo + Yukarı Titre Glyburide N = 267 |
|---|---|---|---|
| * Kurtarmaya ihtiyaç duyan hastalar için metformin kurtarma terapisi öncesinde çalışmadaki son gözlemi veya son gözlemi kullanarak tedavi etme niyeti. | |||
| †En küçük kareler, taban çizgisi değeri için ayarlanmış ortalama anlamına gelir. | |||
| c p-değeri <0.0001, plasebo + yukarı titre edilmiş gliburide kıyasla | |||
| § plasebo + yukarı titre edilmiş gliburit ile karşılaştırıldığında p değeri <0.05 | |||
| Hemoglobin A1C (%) | N = 246 | N = 250 | N = 264 |
| Temel (ortalama) | 8.4 | 8.5 | 8.4 |
| Taban çizgisinden değişim (ayarlanmış ortalama†) | −0.5 | −0.6 | +0.1 |
| Yukarı titre edilmiş gliburitten fark (ayarlanmış ortalama†) | −0.6c | −0.7c | |
| % 95 Güven Aralığı | (−0.8, −0.5) | (−0.9, −0.6) | |
| A1C'ye ulaşan hastaların yüzdesi | 22% §(55/246) | 23% §(57/250) | 9% (24/264) |
| Açlık Plazma Glikozu (mg / dL) | N = 247 | N = 252 | N = 265 |
| Temel (ortalama) | 170 | 175 | 174 |
| Taban çizgisinden değişim (ayarlanmış ortalama†) | −7 | −10 | +1 |
| Yukarı titre edilmiş gliburitten fark (ayarlanmış ortalama†) | −8 § | −10 § | |
| % 95 Güven Aralığı | (−14, −1) | (−17, −4) | |
| 2 saatlik Postprandiyal Glikoz (mg / dL) | N = 195 | N = 202 | N = 206 |
| Temel (ortalama) | 309 | 315 | 323 |
| Taban çizgisinden değişim (ayarlanmış ortalama†) | −31 | −34 | +8 |
| Yukarı titre edilmiş gliburitten fark (ayarlanmış ortalama†) | −38 § | −42 § | |
| % 95 Güven Aralığı | (−50, −27) | (−53, −31) |
Tedavi Naif Hastalarda Metformin ile Birlikte Uygulama
Bu 24 haftalık, randomize, çift kör, plasebo kontrollü çalışmaya tip 2 diyabetes mellituslu toplam 1306 tedaviye-naif hasta katılmıştır. glisemik kontrolü yetersiz olan hastalarda metformin ile birlikte uygulanan Onglyza'nın diyet ve egzersiz üzerindeki etkinliğini ve güvenilirliğini değerlendirmek (A1C -% 8 -% 12) tek başına. Hastaların bu çalışmaya alınabilmeleri için tedaviye uygun olmaları gerekiyordu.
Uygunluk kriterlerini karşılayan hastalar tek kör, 1 haftalık, diyet ve egzersiz plasebo giriş periyoduna alındı. Hastalar dört tedavi kolundan birine randomize edildi: Onglyza 5 mg + metformin 500 mg, saksagliptin 10 mg + metformin 500 mg, saksagliptin 10 mg + plasebo veya metformin 500 mg + plasebo. Onglyza günde bir kez dozlandı. Metformin kullanan 3 tedavi grubunda metformin dozu, tolere edildiği gibi FPG'ye göre günde en fazla 2000 mg'a kadar, tolere edildiği gibi günlük 500 mg artışlarla haftalık olarak titre edilmiştir. Çalışmalar sırasında spesifik glisemik hedeflere ulaşamayan hastalar, ek tedavi olarak pioglitazon kurtarma ile tedavi edildi.
Onglyza 5 mg artı metforminin birlikte uygulanması, plasebo artı metformine kıyasla A1C, FPG ve PPG'de önemli gelişmeler sağlamıştır (Tablo 7).
Tablo 7: Tedavi-Naif Hastalarda Metformin ile Onglyza Birlikte Uygulamanın Plasebo Kontrollü Bir Denemesinde 24. Haftada Glisemik Parametreler
| Etkinlik Parametresi | Onglyza 5 mg + Metformin N = 320 |
plasebo + Metformin N = 328 |
|---|---|---|
| * Kurtarmaya ihtiyaç duyan hastalar için pioglitazon kurtarma terapisi öncesinde çalışma üzerinde son gözlem veya son gözlem kullanarak tedavi etme niyeti. | ||
| †En küçük kareler, taban çizgisi değeri için ayarlanmış ortalama anlamına gelir. | ||
| c Plasebo + metformine kıyasla p değeri <0.0001 | ||
| § Plasebo + metformine kıyasla p değeri <0.05 | ||
| Hemoglobin A1C (%) | N = 306 | N = 313 |
| Temel (ortalama) | 9.4 | 9.4 |
| Taban çizgisinden değişim (ayarlanmış ortalama†) | −2.5 | −2.0 |
| Plasebo + metforminden fark (ayarlanmış ortalama†) | −0.5c | |
| % 95 Güven Aralığı | (−0.7, −0.4) | |
| A1C'ye ulaşan hastaların yüzdesi | 60% §(185/307) | 41% (129/314) |
| Açlık Plazma Glikozu (mg / dL) | N = 315 | N = 320 |
| Temel (ortalama) | 199 | 199 |
| Taban çizgisinden değişim (ayarlanmış ortalama†) | −60 | −47 |
| Plasebo + metforminden fark (ayarlanmış ortalama†) | −13 § | |
| % 95 Güven Aralığı | (−19, −6) | |
| 2 saatlik Postprandiyal Glikoz (mg / dL) | N = 146 | N = 141 |
| Temel (ortalama) | 340 | 355 |
| Taban çizgisinden değişim (ayarlanmış ortalama†) | −138 | −97 |
| Plasebo + metforminden fark (ayarlanmış ortalama†) | −41 § | |
| % 95 Güven Aralığı | (−57, −25) |
üst
Nasıl tedarik edildi
Onglyza ™ (saksagliptin) tabletlerin her iki tarafında işaretler vardır ve Tablo 8'de listelenen güçlü ve paketlerde mevcuttur.
| Tablet kuvvet |
Film Kaplı Tablet Renk / Şekli |
Tablet İşaretleri |
Paket Boyutu | NDC Kodu |
|---|---|---|---|---|
| 5 mg | pembe bikonveks, yuvarlak |
Mavi mürekkeple bir tarafta "5" ve arkada "4215" | 30 şişe 90 şişe 500 şişe 100'lü blister |
0003-4215-11 0003-4215-21 0003-4215-31 0003-4215-41 |
| 2.5 mg | soluk sarı ila açık sarı bikonveks, yuvarlak |
Mavi mürekkeple bir tarafta "2.5" ve arkada "4214" | 30 şişe 90 şişe |
0003-4214-11 0003-4214-21 |
Depolama ve Elleçleme
20 ° -25 ° C (68 ° -77 ° F) sıcaklıkta saklayın; 15 ° -30 ° C'ye (59 ° -86 ° F) izin verilen gezilere [bkz. USP Kontrollü Oda Sıcaklığı].
üst
Son Güncelleme: 07/09
E.R. Squibb & Sons, L.L.C.
Onglyza hasta bilgisi
Diyabetin Belirtileri, Belirtileri, Nedenleri, Tedavileri Hakkında Detaylı Bilgi
Bu monograftaki bilgilerin olası tüm kullanımları, talimatları, önlemleri, ilaç etkileşimlerini veya yan etkileri kapsaması amaçlanmamıştır. Bu bilgiler genelleştirilmiştir ve özel tıbbi tavsiye olarak tasarlanmamıştır. Aldığınız ilaçlar hakkında sorularınız varsa veya daha fazla bilgi edinmek istiyorsanız, doktorunuza, eczacınıza veya hemşirenize danışın.
geri dön: Diyabet için tüm İlaçlara göz atın



