Iloperidon (fanapt) Tam Reçete Bilgileri
Marka Adı: Fanapt
Genel Adı: İloperidon
Fanapt (Iloperidon) Reçete Yazma Rehberi (PDF)
İçindekiler:
Kutulu Uyarı
Göstergeler ve kullanımları
Dozaj ve Uygulama
Kontrendikasyonlar
Uyarılar ve Önlemler
Ters tepkiler
İlaç etkileşimleri
Belirli Popülasyonlarda Kullanım
Uyuşturucu Kullanımı ve Bağımlılığı
aşırı doz
Açıklama
Klinik Farmakoloji
Klinik Olmayan Toksikoloji
Klinik çalışmalar
Nasıl tedarik edildi
Brintellix İlaç Rehberi
UYARI: DEMANS İLE İLİŞKİLİ PSİKOZU OLAN YAŞLI HASTALARDA MORTALİTE ARTIŞI
Antipsikotik ilaçlarla tedavi edilen demansla ilişkili psikozu olan yaşlı hastalar ölüm riskini arttırmaktadır. Demansla ilişkili psikozu olan hastaların tedavisi için FANAPT onaylanmamıştır.
Göstergeler ve kullanımları
FANAPT® yetişkinlerde şizofreni tedavisi için endikedir.
Bu durum için mevcut alternatif tedaviler arasında karar verirken, reçete yazan FANAPT'nin QTc aralığının uzaması ile ilişkili olduğunu bulmalıdır. QTc aralığının uzaması, diğer bazı ilaçlarda torsade de'ye neden olma kabiliyeti ile ilişkilidir. Ani ölümle sonuçlanabilecek potansiyel olarak ölümcül bir polimorfik ventriküler taşikardi olan pointes tipi aritmi ölüm. Birçok durumda bu, önce diğer ilaçların denenmesi gerektiği sonucuna yol açacaktır. FANAPT'ın torsade de pointes'e neden olup olmayacağı veya ani ölüm oranını artıracağı henüz bilinmiyor.
Hastalar etkili bir FANAPT dozuna titre edilmelidir. Bu nedenle, benzer bir titrasyon gerektirmeyen diğer antipsikotik ilaçlarla karşılaştırıldığında semptomların kontrolü tedavinin ilk 1-2 haftasında ertelenebilir. Şizofreni tedavisi için antipsikotik bir ilaç seçerken reçeteler bu gecikmeye dikkat etmelidir.
aşağıdaki hikayeye devam et
Dozaj ve Uygulama
Olağan Doz
Alfa-adrenerjik bloke edici özellikleri nedeniyle ortostatik hipotansiyonu önlemek için FANAPT düşük başlangıç dozundan yavaş titre edilmelidir. FANAPT tabletleri için önerilen başlangıç dozu günde iki kez oral yoldan 1 mg'dır. Günde iki kez 6-12 mg (12_24 mg / gün) hedef aralığına ulaşmak için doz artışı, günde iki kez 2 mg'ı (4 mg / gün) aşmayacak günlük dozaj ayarlamaları ile yapılabilir. Önerilen maksimum doz günde iki kez 12 mg'dır (24 mg / gün). 24 mg / gün üzerindeki FANAPT dozları, klinik çalışmalarda sistematik olarak değerlendirilmemiştir. Etkinlik, günde iki kez 6 ila 12 mg'lık bir doz aralığında FANAPT ile gösterilmiştir. Reçeteli hastalar, hastaların etkili bir FANAPT dozuna titre edilmesi gerektiğine dikkat etmelidir. Bu nedenle, benzer titrasyon gerektirmeyen diğer antipsikotik ilaçlarla karşılaştırıldığında semptomların kontrolü tedavinin ilk 1-2 haftasında ertelenebilir. Reçete yazan kişiler ayrıca FANAPT kullanımı ile ilişkili bazı olumsuz etkilerin doza bağlı olduğunun farkında olmalıdır. FANAPT yemeklere bakılmaksızın uygulanabilir.
Özel Popülasyonlarda Dozaj
Potansiyel CYP2D6 inhibitörleriyle birlikte FANAPT alan hastalar için dozaj ayarlaması: FANAPT dozu fluoksetin veya paroksetin gibi güçlü CYP2D6 inhibitörleri ile birlikte uygulandığında yarı yarıya azaltılır. CYP2D6 inhibitörü kombinasyon terapisinden çekildiğinde, FANAPT dozu daha önce olduğu yere yükseltilmelidir.
Potansiyel CYP3A4 inhibitörleri ile birlikte FANAPT alan hastalar için dozaj ayarlaması: FANAPT dozu ketokonazol gibi güçlü CYP3A4 inhibitörleri ile birlikte uygulandığında yarı yarıya azaltılır veya klaritromisin. CYP3A4 inhibitörü kombinasyon terapisinden çekildiğinde, FANAPT dozu daha önce olduğu yere yükseltilmelidir.
CYP2D6'nın zayıf metabolizörleri olan FANAPT alan hastalar için dozaj ayarlaması: CYP2D6'nın zayıf metabolizörleri için FANAPT dozu yarı yarıya azaltılmalıdır.
Karaciğer yetmezliği: Hafif karaciğer yetmezliği olan hastalarda FANAPT'ye doz ayarlaması gerekmez. Orta derecede karaciğer yetmezliği olan hastalar, klinik olarak endike ise dozun azaltılmasını gerektirebilir. Şiddetli karaciğer yetmezliği olan hastalar için FANAPT önerilmez.
Bakım Tedavisi
Uzun süreli bir çalışmada, FANAPT, FANAPT'de 24 mg / gün'e kadar stabilize edilen şizofreni hastalarında nüks etme süresini geciktirmede etkili olmuştur. Bakım tedavisine duyulan ihtiyacı belirlemek için hastalar periyodik olarak yeniden değerlendirilmelidir.
Önceden Durdurulmuş Hastalarda Tedavinin Yeniden Başlatılması Özellikle yeniden başlatılmasına yönelik veri bulunmamasına rağmen Tedavinin başlangıcında, hastalar FANAPT aralığından daha uzun süre ara verdiklerinde, başlangıç titrasyon programının takip edilmesi önerilir. 3 günden fazla.
üst
Dozaj formları ve güçlü yönleri
FANAPT tabletleri aşağıdaki kuvvetlerde mevcuttur: 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg ve 12 mg. Tabletler beyaz, yuvarlak, düz, eğik kenarlı ve bir tarafında debelenmiş “” logosu ve “1”, “2”, “4”, “6”, “8”, “10”, veya “12” diğer tarafta debossed.
üst
Kontrendikasyonlar
FANAPT, ürüne aşırı duyarlılık reaksiyonu olduğu bilinen kişilerde kontrendikedir. Anafilaksi, anjiyoödem ve diğer aşırı duyarlılık reaksiyonları bildirilmiştir.
üst
UYARILAR VE ÖNLEMLER
Demansla İlgili Psikozlu Yaşlı Hastalarda Ölüm Oranının Artması
Antipsikotik ilaçlar, demansla ilişkili psikozlu yaşlı hastalarda her türlü ölüm riskini arttırır. 17 demansla ilişkili psikoz plasebo kontrollü çalışmanın analizi (modal süre 10 hafta ve büyük ölçüde atipik alan hastalarda) antipsikotik ilaçlar), ilaçla tedavi edilen hastalarda, plaseboyla tedavi edilen hastalardakinden 1,6 ila 1,7 kat daha fazla ölüm riski ortaya koymuştur. Tipik bir 10 haftalık kontrollü çalışma boyunca, ilaçla tedavi edilen hastalarda ölüm oranı, plasebo ile tedavi edilen hastalarda yaklaşık% 2.6'lık bir orana kıyasla, yaklaşık% 4.5 idi.
Ölüm nedenleri çeşitlilik gösterse de, ölümlerin çoğu doğada ya kardiyovasküler (örn. Kalp yetmezliği, ani ölüm) ya da bulaşıcı (örneğin zatürree) gibi görünüyordu. Demansla ilişkili psikozu olan hastaların tedavisi için FANAPT onaylanmamıştır.
Demansla İlişkili Psikozlu Yaşlı Hastalarda İnme Dahil Serebrovasküler Advers Reaksiyonlar
Demanslı yaşlı kişilerde plasebo kontrollü çalışmalarda, risperidona randomize edilen hastalar, aripiprazol ve olanzapin inme ve ölümcül dahil geçici iskemik atak insidansında daha yüksekti felç. Demansla ilişkili psikozu olan hastaların tedavisi için FANAPT onaylanmamıştır.
QT Uzaması
Şizofreni veya şizoaffektif bozukluğu (n = 160) olan hastalarda açık etiketli bir QTc çalışmasında FANAPT, günde iki kez 12 mg'lik bir iloperidon dozunda 9 msn'lik QTc uzaması ile ilişkilendirilmiştir. FANAPT'in QT aralığı üzerindeki etkisi CYP450 2D6 veya 3A4 metabolik inhibisyonu (günde iki kez 20 mg paroksetin ve günde iki kez 200 mg ketokonazol) varlığı ile arttırıldı. Hem 2D6 hem de 3A4 için metabolik inhibisyon koşulları altında, günde iki kez FANAPT 12 mg, yaklaşık 19 ms taban çizgisinden ortalama bir QTcF artışı ile ilişkilendirildi.
Pazarlama öncesi klinik program sırasında hiçbir torsade de pointes veya diğer ciddi kardiyak aritmiler gözlenmemiştir.
Sınıf 1A (örn., Kinidin, prokainamid) dahil QTc'yi uzattığı bilinen diğer ilaçlarla birlikte FANAPT kullanımından kaçınılmalıdır. veya Sınıf III (örn., amiodaron, sotalol) antiaritmik ilaçlar, antipsikotik ilaçlar (örneğin, klorpromazin, tioridazin), antibiyotikler (örn., gatifloksasin, moksifloksasin) veya QTc aralığını uzattığı bilinen herhangi bir başka ilaç sınıfı (örn., pentamidin, levomethadil asetat, metadon). Konjenital uzun QT sendromlu hastalarda ve kardiyak aritmi öyküsü olan hastalarda FANAPT'den de kaçınılmalıdır.
Bazı durumlar, (1) bradikardi dahil olmak üzere QTc aralığını uzatan ilaçların kullanımı ile ilişkili olarak torsade de pointes ve / veya ani ölüm riskini artırabilir. (2) hipokalemi veya hipomagnezemi; (3) QTc aralığını uzatan diğer ilaçların birlikte kullanımı; ve (4) QT aralığının konjenital uzamasının varlığı; (5) son zamanlarda akut miyokard enfarktüsü; ve / veya (6) telafi edilmemiş kalp yetmezliği.
FANAPT metabolizmasını inhibe eden ilaçlarla ve CYP2D6 aktivitesinde azalma olan hastalarda FANAPT reçete edilirken dikkatli olunmalıdır.
Önemli risk altında olan FANAPT tedavisi için düşünülen hastaların önerilmesi elektrolit bozuklukları bazal serum potasyum ve periyodik olarak magnezyum ölçümlerine sahiptir izlenmesi. Hipokalemi (ve / veya hipomagnezemi) QT uzaması ve aritmi riskini artırabilir. Önemli kardiyovasküler hastalık öyküsü olan hastalarda, örneğin QT'de FANAPT'den kaçınılmalıdır. uzama, son zamanlarda akut miyokard enfarktüsü, kompanse olmayan kalp yetmezliği veya kardiyak aritmi. Kalıcı QTc ölçümlerinin> 500 msn olduğu tespit edilen hastalarda FANAPT tedavisine son verilmelidir.
FANAPT alan hastalarda kardiyak aritmilerin oluşumunu gösterebilecek semptomlar görülürse, ör. baş dönmesi, çarpıntı veya senkop, reçete yazan kişi kardiyak da dahil olmak üzere daha fazla değerlendirme başlatmalıdır. izlenmesi.
Nöroleptik Malign Sendrom (NMS)
FANAPT dahil antipsikotik ilaçların uygulanması ile ilişkili olarak bazen Nöroleptik Malign Sendrom (NMS) olarak adlandırılan potansiyel olarak ölümcül bir semptom kompleksi bildirilmiştir. Klinik belirtiler arasında hiperpireksi, kas sertliği, değişen zihinsel durum (katatonik belirtiler dahil) ve otonomik instabilite kanıtı (düzensiz nabız veya kan basıncı, taşikardi, terleme ve kardiyak) ritim bozukluğu). Ek belirtiler arasında yüksek kreatin fosfokinaz, miyoglobinüri (rabdomiyoliz) ve akut böbrek yetmezliği sayılabilir. Bu sendromlu hastaların tanısal değerlendirmesi karmaşıktır. Bir tanıya ulaşırken, klinik sunumun içerdiği vakaları belirlemek önemlidir hem ciddi tıbbi hastalık hem de tedavi edilmemiş veya yetersiz tedavi edilmiş ekstrapiramidal belirti ve bulgular (EPS). Ayırıcı tanıda dikkat edilmesi gereken diğer önemli hususlar arasında merkezi antikolinerjik toksisite, sıcak çarpması, ilaç ateşi ve primer merkezi sinir sistemi (CNS) patolojisi bulunur.
Bu sendromun yönetimi şunları içermelidir: (1) antipsikotik ilaçların ve eşzamanlı tedavi için gerekli olmayan diğer ilaçların derhal kesilmesi, (2) yoğun semptomatik tedavi ve tıbbi izleme ve (3) belirli tedavilerin mevcut olduğu eşlik eden ciddi tıbbi sorunların tedavisi. NMS için spesifik farmakolojik tedavi rejimleri hakkında genel bir anlaşma yoktur.
Bir hasta, NMS'den iyileştikten sonra antipsikotik ilaç tedavisine ihtiyaç duyuyorsa, ilaç tedavisinin potansiyel yeniden girişi dikkatle düşünülmelidir. NMS nüksleri bildirildiği için hasta dikkatle izlenmelidir.
Tardif Diskinezi
Tardif diskinezi, antipsikotik ilaçlarla tedavi edilen hastalarda gelişebilecek, potansiyel olarak geri döndürülemez, istemsiz, diskinezik hareketlerden oluşan bir sendromdur. Sendromun prevalansı yaşlılar, özellikle yaşlı kadınlar arasında en yüksek gibi görünse de, antipsikotik tedavinin başlangıcında, hastaların hangi ilaçları geliştirebileceğini tahmin etmek için yaygınlık tahminlerine güvenmek sendromu. Antipsikotik ilaç ürünlerinin geç diskineziye neden olma potansiyellerinde farklılık gösterip göstermediği bilinmemektedir.
Geç diskinezi gelişme riskinin ve geri dönüşümsüz hale gelme olasılığının olduğuna inanılmaktadır. tedavi süresi ve uygulanan toplam antipsikotik dozun toplam dozu arttıkça artışlar. Bununla birlikte, sendrom, daha az yaygın olmasına rağmen, düşük dozlarda nispeten kısa tedavi sürelerinden sonra gelişebilir.
Antipsikotik tedavi kesilirse, sendrom kısmen veya tamamen iyileşebilir, ancak yerleşik geç diskinezi vakaları için bilinen bir tedavi yoktur. Bununla birlikte, antipsikotik tedavinin kendisi, sendromun belirti ve semptomlarını baskılayabilir (veya kısmen baskılayabilir) ve böylece muhtemelen altta yatan süreci maskeleyebilir. Semptomatik supresyonun sendromun uzun süreli seyri üzerindeki etkisi bilinmemektedir.
Bu düşünceler göz önüne alındığında, FANAPT geç diskinezinin oluşumunu en aza indirecek şekilde reçete edilmelidir. Kronik antipsikotik tedavi genellikle (1) 'in yanıt verdiği bilinen kronik bir hastalığı olan hastalar için ayrılmalıdır. antipsikotik ilaçlar ve (2) alternatif, eşit derecede etkili, ancak potansiyel olarak daha az zararlı tedavilerin mevcut olmadığı veya uygun. Kronik tedaviye ihtiyaç duyan hastalarda, tatmin edici bir klinik yanıt üreten en küçük doz ve en kısa tedavi süresi aranmalıdır. Sürekli tedaviye olan ihtiyaç periyodik olarak yeniden değerlendirilmelidir.
FANAPT hastalarında geç diskinezinin belirti ve semptomları ortaya çıkarsa, ilacın kesilmesi düşünülmelidir. Bununla birlikte, bazı hastalar, sendromun varlığına rağmen FANAPT ile tedavi gerektirebilir.
Metabolik Değişimler
Atipik antipsikotik ilaçlar kardiyovasküler / serebrovasküler riski artırabilecek metabolik değişikliklerle ilişkilendirilmiştir. Bu metabolik değişiklikler arasında hiperglisemi, dislipidemi ve vücut ağırlığı artışı bulunur. Tüm atipik antipsikotik ilaçların bazı metabolik değişiklikler ürettiği gösterilse de, sınıftaki her ilacın kendine özgü risk profili vardır.
Hiperglisemi ve Diyabetes Mellitus
FANAPT de dahil olmak üzere atipik antipsikotiklerle tedavi edilen hastalarda aşırı ve ketoasidoz veya hiperosmolar koma veya ölümle ilişkili hiperglisemi bildirilmiştir. Atipik antipsikotik kullanımı ile glikoz anormallikleri arasındaki ilişkinin değerlendirilmesi, artmış olma olasılığı nedeniyle karmaşıktır. şizofreni hastalarında arka plan diyabet riski ve genel olarak artan diyabetes mellitus insidansı nüfus. Bu çelişkiler göz önüne alındığında, atipik antipsikotik kullanımı ile hiperglisemiye bağlı advers olaylar arasındaki ilişki tam olarak anlaşılamamıştır. Bununla birlikte, epidemiyolojik çalışmalar, bu çalışmalara dahil edilen atipik antipsikotiklerle tedavi edilen hastalarda hiperglisemi ile ilişkili advers olay riskinin arttığını göstermektedir.
Atipik antipsikotiklerle başlamış diyabetes mellitus tanısı konmuş hastalar, glikoz kontrolünün kötüleşmesi açısından düzenli olarak izlenmelidir. Tedaviye başlayan diabetes mellitus için risk faktörleri olan hastalar (örn., Obezite, aile diyabet öyküsü) atipik antipsikotikler tedavinin başlangıcında ve periyodik olarak periyodik olarak açlık kan şekeri testine tabi tutulmalıdır. tedavisi. Atipik antipsikotiklerle tedavi edilen herhangi bir hasta, polidipsi, poliüri, polifaji ve halsizlik de dahil olmak üzere hiperglisemi semptomları açısından izlenmelidir. Atipik antipsikotiklerle tedavi sırasında hiperglisemi semptomları gelişen hastalara açlık kan şekeri testi yapılmalıdır. Bazı durumlarda, atipik antipsikotik kesildiğinde hiperglisemi düzelmiştir; bununla birlikte, bazı hastalarda şüpheli ilacın kesilmesine rağmen antidiyabetik tedavinin sürdürülmesi gerekmiştir.
Açlık kan örnekleri alınan şizofreni hastalarında 4 haftalık, sabit dozlu bir çalışmadan elde edilen veriler Tablo 1'de sunulmuştur.
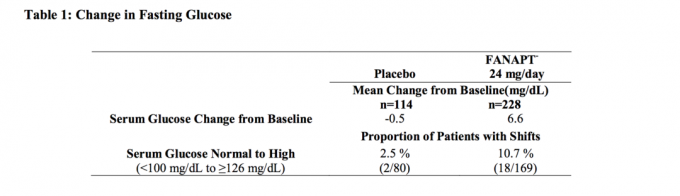
Uzun süreli deneyler de dahil olmak üzere klinik çalışmalardan elde edilen glikoz verilerinin birleştirilmiş analizleri Tablo 2'de gösterilmiştir.
dislipidemi
Atipik antipsikotiklerle tedavi edilen hastalarda lipitlerde istenmeyen değişiklikler gözlenmiştir.
Şizofrenili erişkin bireylerde açlık kan örneklerinin alındığı plasebo kontrollü, 4 haftalık sabit dozlu stud y'den elde edilen veriler Tablo 3'te sunulmaktadır.

Uzun süreli deneyler de dahil olmak üzere klinik çalışmalardan kolesterol ve trigliserit verilerinin toplanmış analizleri Tablo 4 ve Tablo 5'te gösterilmektedir.


Kilo almak
Atipik antipsikotik kullanımda kilo artışı gözlenmiştir. Ağırlığın klinik olarak izlenmesi önerilir.
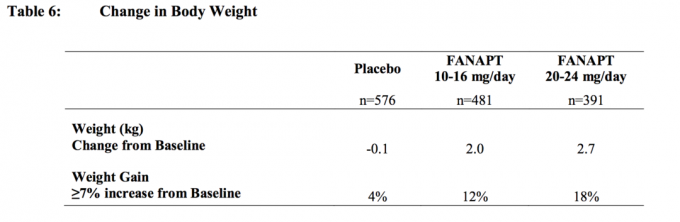
Tüm kısa ve uzun dönemli çalışmalarda, son noktadaki başlangıç değerinden genel ortalama değişim 2,1 kg idi.
Vücut ağırlığındaki değişiklikler (kg) ve vücut ağırlığında ≥% 7 artış gösteren deneklerin oranı 4'ten yetişkin bireylerde plasebo kontrollü, 4- veya 6 haftalık, sabit veya esnek doz çalışmaları Çizelge 6.
Nöbetler
Kısa süreli plasebo kontrollü çalışmalarda (4-6 hafta), FANAPT ile tedavi edilen hastaların% 0.1'inde (1/1344), plaseboda% 0.3'e (2/587) kıyasla nöbetler meydana geldi. Diğer antipsikotiklerde olduğu gibi, FANAPT nöbet öyküsü olan hastalarda veya nöbet eşiğini potansiyel olarak düşüren durumlarda dikkatli kullanılmalıdır. Nöbet eşiğini düşüren koşullar 65 yaş ve üzerindeki bir popülasyonda daha yaygın olabilir.
Ortostatik Hipotansiyon ve Senkop
FANAPT baş dönmesi, taşikardi ve senkop ile ilişkili ortostatik hipotansiyona neden olabilir. Bu alfa-adrenerjik antagonist özelliklerini yansıtır. Dozun önerildiği gibi yavaşça artırıldığı çift kör plasebo kontrollü kısa süreli çalışmalarda yukarıda, FANAPT ile tedavi edilen hastaların% 0.4'ünde (5/1344) senkop,% 0.2'de (1/587) Plasebo. 20-24 mg / gün verilen hastaların% 5'inde, 10-16 mg / gün verilen hastaların% 3'ünde ve plasebo verilen hastaların% 1'inde ortostatik hipotansiyon bildirilmiştir. Daha hızlı titrasyonun ortostatik hipotansiyon ve senkop oranını arttırması beklenir.
Bilinen kardiyovasküler hastalığı olan hastalarda (örn. Kalp yetmezliği, miyokard enfarktüsü öyküsü, iskemi veya iletim) FANAPT dikkatli kullanılmalıdır anormallikler), serebrovasküler hastalık veya hastayı hipotansiyona (dehidrasyon, hipovolemi ve antihipertansif tedavi) yatkın hale getiren durumlar ilaçlar). Hipotansiyona yatkın hastalarda ortostatik yaşamsal bulguların izlenmesi düşünülmelidir.
Lökopeni, Nötropeni ve Agranülositoz
Klinik araştırma ve pazarlama sonrası deneyimde, antipsikotik ajanlarla geçici olarak ilişkili lökopeni / nötropeni olayları bildirilmiştir. Agranülositoz (ölümcül vakalar dahil) de bildirilmiştir.
Lökopeni / nötropeni için olası risk faktörleri arasında önceden mevcut düşük beyaz kan hücresi sayısı (WBC) ve ilaca bağlı lökopeni / nötropeni öyküsü bulunur. Önceden var olan düşük WBC'ye veya ilaca bağlı lökopeni / nötropeni öyküsü olan hastalar tam kan sayımını (CBC) izlemelidir Tedavinin ilk birkaç ayında sıklıkla ve diğer nedensel yokluğunda WBC'de düşüşün ilk belirtisinde FANAPT tedavisine son verilmelidir. faktörler.
Nötropenili hastalar ateş veya diğer semptom veya enfeksiyon belirtileri açısından dikkatle izlenmeli ve bu belirtiler veya belirtiler ortaya çıkarsa derhal tedavi edilmelidir. Şiddetli nötropeni (mutlak nötrofil sayısı <1000 / mm3) olan hastalar FANAPT'yi bırakmalı ve iyileşme olana kadar WBC'lerini takip etmelidir.
Hiperprolaktinemi
Dopamin D2 reseptörlerini antagonize eden diğer ilaçlarda olduğu gibi, FANAPT prolaktin seviyelerini yükseltir.
Hiperprolaktinemi hipotalamik GnRH'yi baskılayabilir ve bu da hipofiz gonadotropin sekresyonunun azalmasına neden olabilir. Bu da hem kadın hem de erkek hastalarda gonadalsteroidogenezi bozarak üreme fonksiyonunu inhibe edebilir. Prolaktin yükselen bileşiklerle galaktore, amenore, jinekomasti ve iktidarsızlık bildirilmiştir. Hipogonadizm ile ilişkili olduğunda uzun süredir devam eden hiperprolaktinemi, hem kadın hem de erkek hastalarda kemik yoğunluğunun azalmasına neden olabilir.
Doku kültürü deneyleri, insan meme kanserlerinin yaklaşık üçte birinin in vitro prolaktin bağımlı olduğunu, Daha önce saptanmış göğsü olan bir hastada bu ilaçların reçetesi düşünülüyorsa potansiyel önem faktörü kanser. FANAPT ile tedavi edilen farelerde ve sıçanlarda meme bezi proliferatif değişiklikleri ve serum prolaktin artışları görüldü. Ne klinik çalışmalar ne de bugüne kadar yapılan epidemiyolojik çalışmalar, bu ilaç sınıfının kronik uygulaması ile insanlarda tümör oluşumu arasında bir ilişki göstermemiştir; mevcut kanıtlar şu anda kesin olamayacak kadar sınırlı kabul edilmektedir.
Kısa süreli plasebo kontrollü bir çalışmada (4 hafta), plazma prolaktin düzeylerinde başlangıçtan bitiş noktasına ortalama değişim FANAPT için 24 mg / gün ile muamele edilmiş grup, 2.6 ng / mL'lik bir artışa kıyasla, 2.6 ng / mL'lik bir artış olmuştur. Plasebo grubu. Bu çalışmada, plasebo grubunda% 12'ye kıyasla FANAPT ile tedavi edilen yetişkinlerin% 26'sında yüksek plazma prolaktin seviyeleri gözlenmiştir. Kısa süreli çalışmalarda FANAPT, diğer bazı antipsikotik ajanlarla gözlemlenen daha büyük prolaktin yükselmelerine kıyasla, mütevazı prolaktin yüksekliği seviyeleri ile ilişkili bulunmuştur. Uzun süreli denemeleri içeren klinik çalışmalardan birleştirilmiş analizde, iloperidon ile tedavi edilen 3210 yetişkinde 2 erkek hastada (% 0.1) jinekomasti bildirilmiştir. plasebo ile tedavi edilen hastalarda% 0 ile karşılaştırıldığında ve 8 kadın denekte (% 0.2) plasebo ile tedavi edilen 3 kadın denekle (% 0.5) karşılaştırıldığında galaktore bildirilmiştir. Hastalar.
Vücut Sıcaklığı Düzenlemesi
Vücudun çekirdek vücut sıcaklığını azaltma yeteneğinin bozulması, antipsikotik ajanlara bağlanmıştır. Çekirdek vücutta yükselmeye katkıda bulunabilecek durumlar yaşayacak hastalar için FANAPT reçete edilirken uygun bakım önerilmektedir. sıcaklık, örneğin, yorucu egzersiz, aşırı sıcağa maruz kalma, antikolinerjik aktivite ile eşzamanlı ilaç alma veya dehidratasyon.
Disfaji
Özofagus dismotilitesi ve aspirasyon antipsikotik ilaç kullanımı ile ilişkilendirilmiştir. Aspirasyon pnömonisi yaşlı hastalarda sık görülen bir morbidite ve mortalite nedenidir. Aspirasyon pnömonisi riski olan hastalarda FANAPT ve diğer antipsikotik ilaçlar dikkatli kullanılmalıdır.
İntihar
Psikotik hastalıkta intihar girişimi olasılığı vardır ve yüksek riskli hastaların yakın gözetimi ilaç tedavisine eşlik etmelidir. Aşırı doz riskini azaltmak için iyi hasta yönetimi ile tutarlı en az miktarda tablet için FANAPT reçeteleri yazılmalıdır.
Priapizm
Pazarlama öncesi FANAPT programında üç priapizm vakası bildirilmiştir. Alfa-adrenerjik bloke edici etkileri olan ilaçların priapizmi indüklediği bildirilmiştir. FANAPT bu farmakolojik aktiviteyi paylaşır. Şiddetli priapizm cerrahi müdahale gerektirebilir.
Bilişsel ve Motor Bozukluk Potansiyeli
FANAPT, diğer antipsikotikler gibi, yargıyı, düşünceyi veya motor becerileri bozma potansiyeline sahiptir. Kısa süreli, plasebo kontrollü çalışmalarda, uyuşukluğun% 11.9'unda (104/874) uyku hali (sedasyon dahil) rapor edilmiştir. 10 mg / gün veya daha yüksek dozlarda FANAPT ile tedavi edilen yetişkin hastalar ile% 5.3 (31/587) Plasebo. Hastalar, FANAPT tedavisinin onları olumsuz etkilemediğinden emin oluncaya kadar otomobiller de dahil olmak üzere tehlikeli makinelerin çalıştırılması konusunda uyarılmalıdır.
üst
Ters tepkiler
Klinik Araştırmalar Deneyimi
Klinik çalışmalar çok çeşitli koşullar altında gerçekleştirildiğinden, bir ilacın klinik çalışmasında gözlenen advers reaksiyon oranları başka bir ilacın klinik çalışmalarındaki oranlarla doğrudan karşılaştırılamaz ve klinikte gözlemlenen oranları yansıtmayabilir uygulama. Aşağıdaki bilgiler, şizofreni tedavisi için 10 mg / gün veya daha yüksek dozlarda FANAPT'ye maruz kalan 3229 hastadan oluşan FANAPT için bir klinik araştırma veri tabanından elde edilmiştir. Bunlardan 999'u en az 6 ay boyunca FANAPT aldı, 657'si en az 12 ay boyunca FANAPT'a maruz kaldı. FANAPT alan bu hastaların hepsi çok dozlu klinik çalışmalara katılıyordu. FANAPT ile tedavi koşulları ve süresi çok değişkendi ve (örtüşen kategorilerde), açık etiketli ve çift kör çalışma evreleri, yatan hastalar ve ayakta tedavi gören hastalar, sabit doz ve esnek doz çalışmaları, kısa ve uzun dönem poz.
Bu bölümlerde sunulan bilgiler 4 plasebo kontrollü, 4 veya 6 haftalık, 10 ila 24 mg arasında günlük dozlarda FANAPT alan hastalarda sabit veya esnek doz çalışmaları (N = 874).
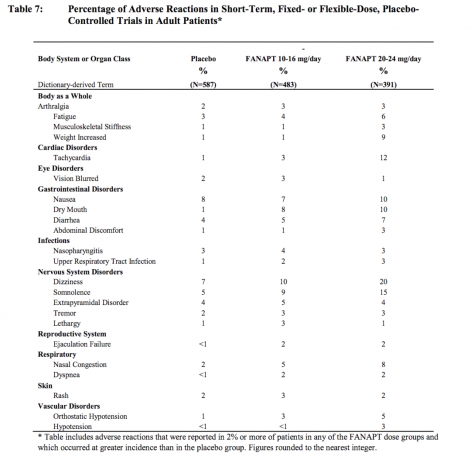
FANAPT ile Tedavi Edilen Hastalarda% 2 veya Daha Fazla ve Plasebodan Daha Sık Görülen Olumsuz Reaksiyonlar
Tablo 7, dört plasebo kontrollü, 4 veya 6 haftalık spontan olarak bildirilen advers reaksiyonların birikmiş vakalarını numaralandırmaktadır. herhangi bir dozda FANAPT ile tedavi edilen hastaların% 2 veya daha fazlasında meydana gelen reaksiyonları listeleyen sabit veya esnek doz çalışmaları ve herhangi bir doz grubundaki FANAPT ile tedavi edilen hastalarda görülme sıklığı, Plasebo.
Klinik Araştırmalarda Doza Bağlı Advers Reaksiyonlar
4 plasebo kontrollü, 4- veya 6 haftalık, sabit veya esnek doz çalışmalarından toplanan verilere dayanarak,% 2'den daha fazla ile ortaya çıkan advers reaksiyonlar FANAPT ile tedavi edilen hastalarda görülme sıklığı ve 20-24 mg / gün FANAPT ile tedavi edilen hastalarda görülme sıklığı, FANAPT 10-16 mg / gün ile tedavi edilen hastalar şunlardır: karın rahatsızlığı, baş dönmesi, hipotansiyon, kas-iskelet sertliği, taşikardi ve ağırlık arttı.
Klinik Araştırmalarda Yaygın ve İlaca Bağlı Olumsuz Reaksiyonlar
4 plasebo kontrollü, 4- veya 6 haftalık, sabit veya esnek doz çalışmalarından toplanan verilere dayanarak, tedavi edilen hastalarda ≥% 5 insidansta aşağıdaki advers reaksiyonlar meydana geldi FANAPT ve en az 1 doz için plasebo sıçan e ile en az iki kez: baş dönmesi, ağız kuruluğu, yorgunluk, burun tıkanıklığı, uyku hali, taşikardi, ortostatik hipotansiyon ve ağırlık arttı. Baş dönmesi, taşikardi ve kilo artışı, 20-24 mg / gün, 10-16 mg / gündekinden en az iki kat daha yaygındı.
Klinik Çalışmalarda Ekstrapiramidal Belirtiler (EPS)
4 plasebo kontrollü, 4 veya 6 haftalık sabit veya esnek doz çalışmalarından toplanan veriler EPS ile ilgili bilgi sağlamıştır. Bu çalışmalardan toplanan advers olay verileri, Tablo 8'de gösterildiği gibi EPS ile ilişkili advers olayların aşağıdaki oranlarını göstermiştir.

Klinik Araştırmalarda Tedavinin kesilmesiyle ilişkili advers reaksiyonlar
4 plasebo kontrollü, 4- veya 6 haftalık, sabit veya esnek doz çalışmalarından toplanan verilere dayanarak, ile tedavi edilen (% 5) ve plasebo ile tedavi edilen (% 5) yan etkiler nedeniyle kesilme insidansındaki fark Hastalar. Kesilmesine neden olan advers olay türleri FANAPT ve plasebo ile tedavi edilen hastalar için benzerdi.
Klinik Araştırmalarda Olumsuz Reaksiyonlarda Demografik Farklılıklar
4 plasebo kontrollü, 4 veya 6 haftalık popülasyon alt gruplarının sabit veya esnek doz çalışmaları, yaş bazında güvenlik farklılıkları hakkında herhangi bir kanıt ortaya koymadı, cinsiyet veya ırk.
Klinik Çalışmalarda Laboratuar Test Anormallikleri
Hematoloji, idrar tahlili veya serum kimyasında meydana gelen değişikliklere bağlı olarak kesilme insidansında FANAPT ve plasebo arasında fark yoktu.
Kısa süreli plasebo kontrollü çalışmalarda (4-6 hafta),% 1.0 (13/1342) iloperidon ile tedavi edilen hastalar vardı hematokrit, randomizasyon sonrası tedavi sırasında genişletilmiş normal aralığın en az bir kez altında,% 0.3'e (2/585) kıyasla Plasebo. Düşük hematokrit için uzatılmış normal aralık, bu çalışmaların her birinde, deneyde kullanılan merkezi laboratuvar için normal aralığın% 15 altında değer olarak tanımlanmıştır.
FANAPT'nin Pazarlama Öncesi Değerlendirmesi Sırasında Diğer Tepkiler
Aşağıda, FANAPT ile tedavi edilen hastalarda advers reaksiyonları yansıtan MedDRA terimlerinin bir listesi bulunmaktadır. 3210 FANAPT ile işleme tabi tutulmuş veritabanı ile bir denemenin herhangi bir aşamasında phase 4 mg / gün çoklu dozlarda Hastalar. Bildirilen tüm reaksiyonlar, Tablo 7'de listelenenler veya Olumsuz Reaksiyonların (6) diğer bölümleri dışında, Uyarılar ve Önlemler (5), bilgilendirici olmayacak kadar genel olan reaksiyon terimleri, 3'ten az hastada bildirilen ve ne ciddi ne de yaşamı tehdit eden, aksi takdirde arka plan reaksiyonları olarak yaygın olan reaksiyonlar ve ilaç olması muhtemel olmayan reaksiyonlar ilişkili.
Reaksiyonlar ayrıca MedDRA sistem organ sınıfı tarafından kategorize edilir ve aşağıdakilere göre azalan frekans sırasına göre listelenir Tanımlar: Sık görülen advers olaylar, en az 1/100 hastada meydana gelen olaylardır (sadece Tablo 7'de listelenmeyenler) ) Listeleme; seyrek advers reaksiyonlar 1/100 ila 1/1000 hastada meydana gelen reaksiyonlardır; 1/1000 hastadan daha az hastada görülen nadir olaylardır.
Kan ve Lenfatik Bozukluklar: Seyrek - anemi, demir eksikliği anemisi; Nadir-lökopeni
Kardiyak Bozukluklar: Sık - çarpıntı; Nadir - aritmi, atriyoventriküler blok birinci derece, kalp yetmezliği (konjestif ve akut dahil)
Kulak ve Labirent Bozuklukları: Seyrek –vertigo, kulak çınlaması
Endokrin Bozuklukları: Seyrek - hipotiroidizm
Göz Hastalıkları: Sık - konjonktivit (alerjik dahil); Seyrek - kuru göz, blefarit, göz kapağı ödemi, göz şişmesi, merceksel opasiteler, katarakt, hiperemi (konjonktival dahil)
Gastrointestinal Hastalıklar: Seyrek - gastrit, tükürük hipersekresyonu, fekal inkontinans, ağız ülseri; Nadir - aftöz stomatit, duodenum ülseri, hiatus fıtığı, hiperklorhidri, dudak ülseri, reflü özofajit, stomatit
Genel Bozukluklar ve İdari Alan Koşulları: Seyrek - ödem (genel, karıncalanma, kalp hastalığına bağlı), yürüme güçlüğü, susuzluk; Nadir - hipertermi
Hepatobiliyer Hastalıklar: Seyrek - kolelitiazis
Araştırmalar: Sık: kilo kaybı; Seyrek - hemoglobin azaldı, nötrofil sayısı arttı, hematokrit azaldı
Metabolizma ve Beslenme Bozuklukları: Seyrek - artan iştah, dehidratasyon, hipokalemi, sıvı tutulumu
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları: Sık - kas ağrısı, kas spazmları; Nadir - tortikollis
Sinir Sistemi Hastalıkları: Nadiren parestezi, psikomotor hiperaktivite, huzursuzluk, amnezi, nistagmus; Nadir - huzursuz bacak sendromu
Psikiyatrik Bozukluklar: Sık - huzursuzluk, saldırganlık, sanrı; Seyrek - düşmanlık, libido azaldı, paranoya, anorgasmi, kafa karışıklığı durumu, mani, katatoni, ruh hali değişimleri, panik saldırı, obsesif kompulsif bozukluk, bulimia nervoza, deliryum, polidipsi psikojenik, dürtü kontrol bozukluğu, majör depresyon
Böbrek ve İdrar Hastalıkları: Sık - idrar kaçırma; Seyrek - dizüri, pollakiüri, enürezis, nefrolitiazis; Nadir - idrar retansiyonu, akut böbrek yetmezliği
Üreme Sistemi ve Meme Bozuklukları: Sık - erektil disfonksiyon; Infrequen - testis ağrısı, amenore, meme ağrısı; Nadir - adet düzensizliği, jinekomasti, menoraji, metrorrhagia, postmenopozal kanama, prostatit.
Solunum, göğüs bozuklukları ve mediastinal hastalıklar: Seyrek - burun kanaması, astım, rinore, sinüs tıkanıklığı, burun kuruluğu; Nadir - kuru boğaz, uyku apne sendromu, nefes darlığı egzersizi
Pazarlama Sonrası Deneyim
FANAPT'nin onay sonrası kullanımı sırasında aşağıdaki advers reaksiyonlar tanımlanmıştır: retrograd ejakülasyon ve aşırı duyarlılık reaksiyonları (anafilaksi dahil; anjiyoödem; boğaz sıkılığı; orofaringeal şişme; yüz, dudak, ağız ve dilin şişmesi; ürtiker; döküntü; ve kaşıntı). Bu reaksiyonlar, belirsiz büyüklükteki bir popülasyondan gönüllü olarak bildirildiğinden, sıklıklarını güvenilir bir şekilde tahmin etmek veya ilaç maruziyeti ile nedensel bir ilişki kurmak mümkün değildir.
üst
İlaç etkileşimleri
FANAPT'in birincil CNS etkileri göz önüne alındığında, diğer merkezi etkili ilaçlar ve alkol ile birlikte alındığında dikkatli olunmalıdır. Alfa-adrenerjik reseptör antagonizması nedeniyle, FANAPT bazı antihipertansif ajanların etkisini arttırma potansiyeline sahiptir.
Diğer İlaçların FANAPT'ı Etkileme Potansiyeli
İloperidon CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19 veya CYP2E1 enzimleri için bir substrat değildir. Bu, iloperidonun bu enzimlerin inhibitörleri veya indükleyicileri ile veya sigara içmek gibi diğer faktörlerle etkileşiminin olası olmadığını gösterir. Hem CYP3A4 hem de CYP2D6, iloperidon metabolizmasından sorumludur. CYP3A4 (örn., Ketokonazol) veya CYP2D6 (örn., Fluoksetin, paroksetin) inhibitörleri, iloperidon eliminasyonunu inhibe edebilir ve artan kan seviyelerine neden olabilir.
Ketokonazol: Güçlü bir CYP3A4 inhibitörü olan ketokonazolün (4 gün boyunca günde iki kez 200 mg), 3 mg'lık tek doz iloperidon ile 19 18-45 yaş arası sağlıklı gönüllüler, iloperidon ve P88 ve P95 metabolitleri eğrisi (AUC) altındaki alanı% 57,% 55 ve% 35 artırdı, sırasıyla. İloperidon dozları, ketokonazol veya diğer güçlü CYP3A4 inhibitörleri (örn., İtrakonazol) ile birlikte uygulandığında yaklaşık yarım oranında azaltılmalıdır. Daha zayıf inhibitörler (örn. Eritromisin, greyfurt suyu) incelenmemiştir. CYP3A4 inhibitörü kombinasyon terapisinden çekildiğinde, iloperidon dozu önceki seviyeye getirilmelidir.
Fluoksetin: 29-44 yaş arası 23 sağlıklı gönüllüye tek bir 3 mg iloperidon dozu olan güçlü bir CYP2D6 inhibitörü olan fluoksetinin (21 gün boyunca günde iki kez 20 mg) birlikte uygulanması, CYP2D6 kapsamlı metabolizörleri olarak sınıflandırılanlar, iloperidon ve onun P88 metaboliti AUC'sini yaklaşık 2 ila 3 kat arttırdı ve P95 metabolitinin AUC'sini bir yarım. Fluoksetin ile uygulandığında iloperidon dozları yarı yarıya azaltılmalıdır. Fluoksetin kombinasyon terapisinden çekildiğinde, iloperidon dozu önceki seviyeye getirilmelidir. Diğer güçlü CYP2D6 inhibitörlerinin benzer etkilere sahip olması beklenir ve uygun doz azaltımlarına ihtiyaç duyulur. CYP2D6 inhibitörü kombinasyon terapisinden çekildiğinde, iloperidon dozu önceki seviyeye yükseltilebilir.
Paroksetin: Güçlü bir CYP2D6 inhibitörü olan paroksetinin (20 mg / gün), çoklu dozlarda iloperidon ile birlikte uygulanması (8 veya günde iki kez 12 mg), 18-65 yaşları arasındaki şizofreni hastalarına, ortalama kararlı durum pik konsantrasyonlarının artmasına neden oldu. iloperidon ve onun metaboliti P88, yaklaşık 1.6 kat, ve metabolit P95'in ortalama kararlı durum pik konsantrasyonlarında bir yarım. Paloksetin ile uygulandığında iloperidon dozları yarı yarıya azaltılmalıdır. Paroksetin kombinasyon terapisinden çekildiğinde, iloperidon dozu önceki seviyeye getirilmelidir. Diğer güçlü CYP2D6 inhibitörlerinin benzer etkilere sahip olması beklenir ve uygun doz azaltımlarına ihtiyaç duyulur. CYP2D6 inhibitörü kombinasyon terapisinden çekildiğinde, iloperidon dozu önceki seviyelere yükseltilebilir.
Paroksetin ve Ketokonazol: Paroksetinin (10 gün boyunca günde bir kez 20 mg), bir CYP2D6 inhibitörü ve ketokonazolün (200 mg) birlikte uygulanması 18-65 yaşları arasındaki şizofreni hastalarına birden fazla iloperidon (günde iki kez 8 veya 12 mg) ile 1,4 kararlı durum konsantrasyonlarında iloperidon ve metaboliti P88'in kat artışı ve P95'in varlığında P95'te 1.4 kat azalma paroksetin. Bu nedenle, her iki metabolik yolunun inhibitörleri ile iloperidon verilmesi, tek başına verilen her iki inhibitörün etkisine katkıda bulunmamıştır. Bu nedenle, hem CYP2D6 hem de CYP3A4 inhibitörü ile birlikte uygulandığında, iloperidon dozları yaklaşık yarıya indirilmelidir.
FANAPT'in Diğer İlaçları Etkileme Potansiyeli
İnsan karaciğer mikrozomlarındaki in vitro çalışmalar, iloperidonun, metabolizmayı önemli ölçüde inhibe etmediğini göstermiştir. Aşağıdaki sitokrom P450 izozimleri tarafından metabolize edilen ilaçlar: CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9 veya CYP2E1'in. Ayrıca, insan karaciğer mikrozomlarındaki in vitro çalışmalar, iloperidonun enzim indükleyici olmadığını göstermiştir. özellikleri, özellikle aşağıdaki sitokrom P450 izozimleri için: CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP3A4 ve CYP3A5.
Dekstrometorfan: Sağlıklı gönüllülerde yapılan bir araştırma, 3 mg dozda dekstrometorfanın (80 mg doz) farmakokinetiğindeki değişikliklerin iloperidon birlikte verildiğinde, toplam maruziyette% 17 artış ve maksimum plazma konsantrasyonlarında Cmaks dekstrometorfan. Bu nedenle, iloperidon ve diğer CYP2D6 substratları arasındaki bir etkileşim olası değildir.
Fluoksetin: 3 mg'lık tek bir iloperidon dozunun fluoksetinin farmakokinetiği üzerinde hiçbir etkisi olmamıştır (günde iki kez 20 mg).
Midazolam (duyarlı bir CYP 3A4 substratı): Şizofreni hastalarında yapılan bir çalışmada, midazolam toplamında% 50'den az bir artış görülmüştür. iloperidon kararlı halde maruz kalma (günde iki kez 10 mg iloperidona 14 günlük oral dozlama) ve midazolam C üzerinde hiçbir etkisi yoktur mak. Bu nedenle, iloperidon ve diğer CYP3A4 substratları arasındaki bir etkileşim olası değildir.
QT Aralığını Uzatan İlaçlar FANAPT, QT aralığını uzatan başka herhangi bir ilaçla birlikte kullanılmamalıdır.
üst
Belirli Popülasyonlarda Kullanım
Hamilelik Maruziyeti Kaydı
Hamilelik sırasında FANAPT'a maruz kalan kadınlarda hamilelik sonuçlarını izleyen bir gebelik maruziyeti kayıt defteri vardır. Daha fazla bilgi için 1-866-961-2388 numaralı telefondan Atipik Antipsikotikler için Ulusal Gebelik Kayıt Defteri ile iletişime geçin veya http://womensmentalhealth.org/clinical-and -Araştırma-programlar / pregnancyregistry /.
Risk Özeti
Gebeliğin üçüncü trimesterinde anneleri FANAPT dahil antipsikotik ilaçlara maruz kalan yenidoğanlarda doğumdan sonra ekstrapiramidal ve / veya yoksunluk belirtileri riski vardır. Gebe kadınlarda sınırlı FANAPT verisi, büyük doğum kusurları ve düşük yapma ilaca bağlı riski bildirmek için yeterli değildir. İloperidon, gebe sıçanlara organogenez sırasında, mg / m2 bazında önerilen maksimum 24 mg / gün insan dozunun 26 katına kadar dozlarda oral olarak uygulandığında teratojenik değildi. Bununla birlikte, hamilelik ve doğum süresini uzattı, hareketsiz doğumları arttırdı, erken intrauterin ölümler, gelişimsel gecikme insidansını artırdı ve doğum sonrası yavru sağkalımını azalttı. İloperidon, mg / m2 bazında MRHD'ye 20 kata kadar olan dozlarda organogenez sırasında hamile tavşanlara oral olarak uygulandığında teratojenik değildi. Bununla birlikte, erken intrauterin ölümleri arttırdı ve aynı zamanda maternal olarak toksik bir doz olan en yüksek dozda fetal canlılığı azalttı.
Belirtilen popülasyon için temel doğum kusurları ve düşük yapma riski bilinmemektedir. ABD genel popülasyonunda, klinik olarak tanınan gebeliklerde majör doğum kusurlarının ve düşüklerin tahmini arka plan riski sırasıyla% 2-4 ve% 15-20'dir.
Klinik Hususlar
Fetal / Yenidoğan Yan Etkileri
Ajitasyon, hipertoni, hipotoni, titreme, uyku hali, solunum sıkıntısı gibi ekstrapiramidal ve / veya yoksunluk belirtileri ve üçüncü trimesterinde anneleri antipsikotik ilaçlara maruz kalan yenidoğanlarda beslenme bozukluğu bildirilmiştir. gebelik. Bu semptomların şiddeti değişmiştir. Bazı yenidoğanlar belirli bir tedavi uygulanmadan saat veya gün içinde iyileşti; diğerleri uzun süre hastaneye yatmayı gerektirdi. Yenidoğanları ekstrapiramidal ve / veya yoksunluk belirtileri açısından izleyin ve belirtileri uygun şekilde yönetin.
Veri
Hayvan Verileri
Bir embriyo-fetal gelişim çalışmasında, gebe sıçanlara 4, 16 veya 64 mg / kg / gün (1.6, 6.5 ve 26 kez iloperidonun önerilen maksimum insan dozu (MRHD) mg / m2 bazında) organogenezisin. En yüksek doz artan erken intrauterin ölümlere, azalmış fetal ağırlık ve uzunluğa, fetal iskelet kemikleşmesinde azalma ve minör fetal iskelet anomalileri insidansında artış ve varyasyonlar; bu doz aynı zamanda anne gıda tüketiminde ve kilo alımında azalmaya neden olmuştur.
Bir embriyo-fetal gelişim çalışmasında, gebe tavşana organogenez döneminde iloperidonun 4, 10 veya 25 mg / kg / gün (mg / m2 bazında MRHD'nin 3, 8 ve 20 katı) verildi. En yüksek doz, erken intrauterin ölümlerin artmasına ve dönemde fetal viabilitenin azalmasına neden olmuştur; bu doz aynı zamanda maternal toksisiteye de neden olmuştur.
Sıçanlara, ön kavramadan veya başlangıcından başlayarak yukarıdakine benzer dozlarda iloperidon verildiği ek çalışmalarda gebeliğin 17. günü ve sütten kesilme yoluyla devam eden, uzun süreli hamilelik ve doğumun dahil olduğu olumsuz üreme etkileri, artmış ölü doğum oranları, fetal viseral varyasyon insidansında artış, fetal ve yavru ağırlıklarında azalma ve doğum sonrası yavrularda azalma sağkalım. Hayatta kalan yavruların nörodavranışsal veya üreme gelişimi üzerinde herhangi bir ilaç etkisi yoktu. Etkisiz dozlar, mg / m2 bazında MRHD'nin 1,6 katı olan 4 mg / kg test edilen en düşük dozda meydana gelen ölü doğum oranlarındaki artış hariç 4 ila 12 mg / kg arasında değişmiştir. Maternal toksisite bu çalışmalarda daha yüksek dozlarda görülmüştür.
İnsanlarda iloperidonun büyük bir dolaşım metaboliti olan iloperidon metaboliti P95, sıçanlarda önemli miktarlar, 20, 80 veya 200 mg oral dozlarda organogenez döneminde hamile sıçanlara verildi kg / gün. Teratojenik etki görülmedi. Gecikmiş iskelet ossifikasyonu tüm dozlarda meydana geldi. Önemli maternal toksisite üretilmemiştir. Test edilen en yüksek dozda P95 (AUC) plazma seviyeleri, iloperidonun MRHD'sini alan insanlardakinin 2 katı idi.
emzirme
Risk Özeti
İnsan sütünde iloperidon veya metabolitlerinin varlığı hakkında bilgi yoktur, iloperidonun emzirilen bir çocuk üzerindeki etkileri veya iloperidonun anne sütü üzerindeki etkileri üretim. Iloperidon sıçan sütünde bulunur. Emzirilen bebeklerde ciddi advers reaksiyon potansiyeli nedeniyle, bir kadına FANAPT tedavisi sırasında emzirmemesini tavsiye edin.
Veriler Emziren sıçanların sütüne radyoaktivitenin aktarılması, 5 mg / kg'da tek bir doz [14C] iloperidonun ardından araştırıldı. Dozdan 4 saat sonra sütteki radyoaktivite konsantrasyonu, aynı zamanda plazmadakinden 10 kat daha fazladır. Bununla birlikte, dozlamadan 24 saat sonra, sütteki radyoaktivite konsantrasyonları plazmadan biraz daha düşük değerlere düşmüştür. Sütteki metabolik profil kalitatif olarak plazmadakine benzerdi.
Pediatrik Kullanım Pediatrik ve ergen hastalarda güvenlik ve etkinlik belirlenmemiştir.
Geriyatrik Kullanım
Şizofreni tedavisinde FANAPT klinik çalışmaları yeterli sayıda içermedi 65 yaş ve üstü hastalar, genç erişkinlerden farklı tepki verip vermediklerini belirlemek için Hastalar. Pazarlama öncesi çalışmalarda FANAPT ile tedavi edilen 3210 hastanın 25'i (% 0,5) ≥65 yaşında ve ≥75 yaşında hiç hasta yoktu.
FANAPT ile tedavi edilen demansla ilişkili psikozu olan yaşlı hastalar, plaseboya kıyasla daha yüksek ölüm riski altındadır. Demansla ilişkili psikozu olan hastaların tedavisi için FANAPT onaylanmamıştır.
Böbrek yetmezliği
FANAPT yüksek oranda metabolize olduğundan, ilacın% 1'inden azı değişmeden atıldığından, tek başına böbrek yetmezliğinin FANAPT'ın farmakokinetiği üzerinde önemli bir etkisi olması muhtemel değildir. Böbrek yetmezliği (kreatinin klerensi <30 mL / dakika) ölçülen 3 analitin herhangi birinde Cmax iloperidonun (tek bir 3 mg dozunda verilir) ve P88 ve P95 metabolitleri üzerinde minimal etkiye sahipti. AUC0-∞, böbrek yetmezliği olanlarda iloperidon, P88 ve P95 için sırasıyla% 24 oranında artmış,% 6 oranında azalmış ve% 52 oranında artmıştır.
Karaciğer yetmezliği
Hafif karaciğer yetmezliği olan hastalarda FANAPT'a doz ayarlamasına gerek yoktur. Orta derecede karaciğer yetmezliği olan hastalar doz azaltımı gerektirebilir. Şiddetli karaciğer yetmezliği olan hastalar için FANAPT önerilmez.
Hafif karaciğer yetmezliği olan erişkinlerde, sağlıklı erişkin kontrollerine kıyasla iloperidon, P88 veya P95 (toplam veya bağlanmamış) farmakokinetiğinde anlamlı bir fark gözlenmemiştir. Orta şiddette karaciğer yetmezliği olan hastalarda P88 aktif metabolitlerine daha yüksek (2 kat) ve daha değişken serbest maruziyet sağlıklı kontrollere kıyasla gözlenirken, iloperidon ve P95'e maruz kalma genellikle benzerdi (% 50'den az değişiklik kontrol). Şiddetli karaciğer yetmezliği olan hastalarda bir çalışma yapılmadığından, ciddi karaciğer yetmezliği olan hastalar için FANAPT önerilmez.
Sigara İçme Durumu
İnsan karaciğer enzimlerini kullanan in vitro çalışmalara dayanarak, FANAPT CYP1A2 için bir substrat değildir; bu nedenle sigara içmenin FANAPT farmakokinetiği üzerinde bir etkisi olmamalıdır.
Gebelik
üst
Uyuşturucu Kullanımı ve Bağımlılığı
Kontrollü Madde
FANAPT kontrollü bir madde değildir.
Taciz
FANAPT, hayvanlarda veya insanlarda istismar, tolerans veya fiziksel bağımlılık potansiyeli nedeniyle sistematik olarak incelenmemiştir. Klinik araştırmalar, ilaç arama davranışı için herhangi bir eğilim göstermese de, bu gözlemler sistematik değildi ve mümkün değil bu deneyime dayanarak bir CNS aktif ilacı olan FANAPT'nin bir kez yanlış, yönlendirilmiş ve / veya kötüye kullanılacağını tahmin etmek pazarlanan. Sonuç olarak, hastalar uyuşturucu bağımlılığı öyküsü açısından dikkatle değerlendirilmeli ve bu hastalar FANAPT kötüye kullanımı veya kötüye kullanımı belirtileri için yakından gözlemlenir (örn. tolerans gelişimi, dozdaki artışlar, ilaç arama davranışı).
üst
Doz Aşımı
İnsan deneyimi
3210'dan fazla hastayı içeren pazarlama öncesi çalışmalarda, yanlışlıkla veya kasıtlı FANAPT doz aşımı yapıldı. bir kerede 48 mg ila 576 mg arasında değişen ve 3 gün boyunca 292 mg arasında değişen 8 hastada belgelenmiştir. dönem. Bu vakalardan ölüm olmadı. FANAPT'nin teyit edilen en büyük tek yutulması 576 mg idi; bu hasta için hiçbir olumsuz fiziksel etki kaydedilmedi. Bir sonraki en büyük FANAPT alımı, 4 günlük bir süre boyunca 438 mg; kardiyak sekeli olmayan bu hasta için ekstrapiramidal semptomlar ve 507 ms'lik bir QTc aralığı bildirilmiştir. Bu hasta FANAPT tedavisine 11 ay daha devam etti.
Genel olarak, bildirilen belirtiler ve semptomlar, FANAPT'in bilinen farmakolojik etkilerinin (örn. Uyuşukluk ve sedasyon, taşikardi ve hipotansiyon) abartılmasından kaynaklanan semptomlardı.
Doz aşımı yönetimi
FANAPT için spesifik bir antidot yoktur. Bu nedenle uygun destekleyici önlemler alınmalıdır. Akut aşırı doz durumunda, doktor bir hava yolu kurmalı ve sürdürmeli ve yeterli oksijenasyon ve ventilasyon sağlamalıdır. Gastrik lavaj (entübasyondan sonra, hasta bilinçsiz ise) ve aktif kömürün müshil ile birlikte uygulanması düşünülmelidir. Doz aşımı sonrası baş ve boynun tıkanması, nöbetleri veya distonik reaksiyon olasılığı, indüklenen kusma ile aspirasyon riski oluşturabilir. Kardiyovasküler izleme hemen başlamalı ve olası aritmileri tespit etmek için sürekli EKG izleme içermelidir. Antiaritmik terapi uygulanırsa, disopiramid, prokainamid ve kinidin kullanılmamalıdır, çünkü bunlar FANAPT'lerin katkı maddesi olabilen QT uzatma etkileri potansiyeline sahiptir. Benzer şekilde, bretilyumun alfa bloke edici özelliklerinin, FANAPT'ninkilere ilave olabileceğini ve bunun da sorunlu hipotansiyon ile sonuçlanmasını beklemek mantıklıdır. Hipotansiyon ve dolaşım çökmesi intravenöz sıvılar veya sempatomimetik ajanlar gibi uygun önlemlerle tedavi edilmelidir. (epinefrin ve dopamin kullanılmamalıdır, çünkü beta uyarımı FANAPT'nin neden olduğu alfa ortamında hipotansiyonu kötüleştirebilir blokajı). Şiddetli ekstrapiramidal semptomlar durumunda antikolinerjik ilaç uygulanmalıdır. Hasta iyileşene kadar yakın tıbbi gözetim devam etmelidir.
üst
Açıklama
FANAPT, piperidinil-benzizoksazol türevlerinin kimyasal sınıfına ait atipik bir antipsikotiktir. Kimyasal adı 4 '- [3- [4- (6-Floro-1,2-benzizoksazol-3-il) piperidino] propoksi] -3’-metoksiasetofenon. Moleküler formülü C24H27FN204'tür ve moleküler ağırlığı 426,48'dir. Yapısal formül:

İloperidon, beyaz ila kirli beyaz arasında ince bir kristal tozdur. Suda pratik olarak çözünmez, 0.1 N HC1 içinde çok az çözünür ve kloroform, etanol, metanol ve asetonitril içinde serbestçe çözünür.
FANAPT tabletleri sadece oral uygulama için tasarlanmıştır. Her tur, kaplamasız
tablet 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg veya 12 mg iloperidon içerir. Aktif olmayan bileşenler şunlardır: laktoz monohidrat, mikrokristalin selüloz, hidroksipropilmetilselüloz, krospovidon, magnezyum stearat, koloidal silikon
dioksit ve saflaştırılmış su (işlem sırasında uzaklaştırılır). Tabletler beyaz, yuvarlak, düz, eğimli kenarlı ve bir tarafında debelenmiş “” logosu ve “1”, “2”, “4”, “6”, “8”, “10”, veya “12” diğer tarafta debossed.
üst
Klinik Farmakoloji
Hareket mekanizması
İloperidonun şizofrenide etki mekanizması bilinmemektedir. Bununla birlikte, iloperidonun etkinliği, bir dopamin tip 2 (D2) ve serotonin tip 2 (5-HT2) antagonizminin bir kombinasyonu yoluyla sağlanabilir.
İloperidon, ana ilaca benzer bir in vitro reseptör bağlanma profiline sahip aktif bir metabolit olan P88'i oluşturur.
Farmakodinamik
Iloperidon, serotonin 5-HT2A dopamin D2'ye bağlanan yüksek (nM) afiniteye sahip bir antagonist görevi görür ve D3reseptörleri ve norepinefrin NEa1 reseptörleri (Ki değerleri 5.6, 6.3, 7.1 ve 0.36 nM, sırasıyla). İloperidon, dopamin D4 ve serotonin 5-HT6 ve 5 -HT7 reseptörlerine karşı orta derecede afiniteye sahiptir (Ki değerleri 25, 43 ve 22, nM sırasıyla serotonin 5-HT1A, dopamin D1 ve histamin H1 reseptörlerine düşük afinite (Ki değerleri 168, 216 ve 437 nM, sırasıyla). İloperidon, kolinerjik muskarinik reseptörler için kayda değer bir afiniteye (Ki> 1000 nM) sahip değildir. İloperidon metaboliti P88'in afinitesi genellikle ana bileşiğinkine eşit veya ondan daha azken, sadece metabolit P95 5-HT2A (Ki değeri 3.91) ve NEα1A, NEα1B, NEα1D ve NEα2C reseptörleri (Ki değerleri 4.7, 2.7, 8.8 ve 4.7 nM) için afinitesi gösterir sırasıyla).
Farmakokinetik
CYP2D6 yaygın metabolizörlerinde (EM) iloperidon, P88 ve P95 için gözlenen ortalama eliminasyon yarı ömürleri sırasıyla 18, 26 ve 23 saattir ve zayıf metabolizörlerde (PM) sırasıyla 33, 37 ve 31 saattir. Kararlı durum konsantrasyonlarına, dozlamadan 3-4 gün sonra ulaşılır. İloperidon birikimi, tek doz farmakokinetikten tahmin edilebilir. İloperidonun farmakokinetiği doz orantısından daha fazladır. İloperidonun ortadan kaldırılması esas olarak 2 P450 izoenzimi, CYP2D6 ve CYP3A4'ü içeren hepatik metabolizma yoluyla olur.
Emilim: Iloperidon, tabletin 2 ila 4 saat içinde meydana gelen pik plazma konsantrasyonları ile uygulanmasından sonra iyi emilir; tablet formülasyonunun oral çözeltiye kıyasla nispi biyoyararlanımı% 96'dır. Standart yüksek yağlı bir yemekle iloperidon uygulanması, Cmax veya AUC'yi önemli ölçüde etkilemedi iloperidon, P88 veya P95, ancak Tmax'ı iloperidon için 1 saat, P88 için 2 saat ve P95. FANAPT yemeklere bakılmaksızın uygulanabilir.
Dağılım: İloperidon, 1340-2800 L arasında belirgin bir dağılım hacmine sahip, 47 ila 102 L / s arasında bir açıklığa (açıklık / biyoyararlanım) sahiptir. Terapötik konsantrasyonlarda, iloperidonun plazmada bağlanmamış fraksiyonu ~% 3'tür ve her metabolitin (P88 ve P95) ~% 8'dir.
Metabolizma ve Eliminasyon: Iloperidon esas olarak 3 biyotransformasyon yolu ile metabolize edilir: karbonil indirgeme, hidroksilasyon (CYP2D6 aracılı) ve O-demetilasyon (CYP3A4 aracılı). 2 baskın iloperidon metaboliti, P95 ve P88 vardır. İloperidon metaboliti P95, geniş metabolizörler (EM) için kararlı durumda plazmadaki iloperidon ve metabolitlerinin EAA'sının% 47.9'unu ve zayıf metabolizörler (PM) için% 25'ini temsil eder. Aktif metabolit P88, EM ve PM'deki toplam plazma maruziyetinin sırasıyla% 19.5 ve% 34.0'ını oluşturur.
Kafkasyalıların yaklaşık% 7-10'u ve siyah / Afrikalı Amerikalıların% 3-8'i CYP2D6'yı metabolize etme kapasitesinden yoksundur substratlar ve zayıf metabolizörler (PM) olarak sınıflandırılırken, geri kalanı orta, geniş veya ultra hızlıdır metabolizörlerin. FANAPT'in fluoksetin gibi bilinen güçlü CYP2D6 inhibitörleri ile birlikte uygulanması 2,3 kat ile sonuçlanır iloperidon plazma maruziyetinde artış ve bu nedenle FANAPT dozunun yarısı uygulanan.
Benzer şekilde, CYP2D6 PM'lerinin EM'lere kıyasla iloperidona daha yüksek maruziyeti vardır ve PM'lerin dozları yarı yarıya azaltılmalıdır. CYP2D6 PM'leri tanımlamak için laboratuvar testleri mevcuttur.
Radyoaktif maddelerin büyük kısmı idrarda (sırasıyla EM ve PM'de ortalama% 58.2 ve% 45.1) geri kazanıldı, dışkı dozda radyoaktivitenin% 19.9'unu (EM) ila% 22.1'ini (PM) oluşturuyordu.
Taşıyıcı Etkileşimi: Iloperidon ve P88, P-gp'nin substratları değildir ve iloperidon, zayıf bir P-gp inhibitörüdür.
üst
Klinik Olmayan Toksikoloji
Karsinogenez, Mutajenez, Doğurganlık Bozukluğu
Kanserojenez: Yaşam boyu kanserojenlik çalışmaları CD-1 farelerinde ve Sprague Dawley sıçanlarında yapılmıştır. İloperidon, CD-1 farelerine 2.5, 5.0 ve 10 mg / kg / gün ve 4, 8 ve 16 mg / kg / gün dozlarında oral yoldan uygulandı. Sprague Dawley sıçanları (sırasıyla 0.5, 1.0 ve 2.0 kez ve 1.6, 3.2 ve 6.5 kez, mg / m2'de 24 mg / gün MRHD temeli). Sadece en düşük dozla (2.5 mg / kg / gün) tedavi edilen dişi farelerde malign meme bezi tümörü insidansı artmıştır. Sıçanlarda neoplazi ile tedaviye bağlı artış yoktu.
İnsanlarda iloperidonun büyük bir dolaşım metaboliti olan fakat farelerde önemli miktarda bulunmayan iloperidon metaboliti P95'in kanserojenik potansiyeli sıçanlar, Wistar sıçanlarında, erkeklerde 25, 75 ve 200 mg / kg / gün oral dozlarda ve 50, 150 ve 250 (400'den düşürülmüş) mg / kg / gün oral dozlarda bir ömür boyu kanserojenlik çalışmasında değerlendirildi. dişiler. Uyuşturucuya bağlı neoplastik değişiklikler erkeklerde, hipofiz bezinde (pars distalis adenomu) tüm dozlarda ve pankreasta (adacık hücresi adenomu) yüksek dozda meydana geldi. Test edilen dozlarda (25, 75 ve 200 mg / kg / gün) erkeklerde P95 (AUC) plazma seviyeleri, insanın iloperidonun MRHD'sinde P95'e yaklaşık olarak sırasıyla 0.4, 3 ve 23 kez maruz kalmıştır.
Mutajenez: Iloperidon, Ames testinde ve in vivo fare kemik iliği ve sıçan karaciğer mikronükleus testlerinde negatifti. İloperidon, Çin Hamster Yumurtalık (CHO) hücrelerinde in vitro olarak bazı sitotoksisiteye neden olan konsantrasyonlarda kromozomal anormalliklere neden oldu.
İloperidon metaboliti P95, Ames testinde, V79 kromozom aberasyon testinde ve bir in vivo fare kemik iliği mikronükleus testinde negatifti.
Doğurganlık Bozukluğu: İloperidon, hem erkek hem de dişi sıçanların tedavi edildiği bir çalışmada 12 ve 36 mg / kg'da doğurganlığı azalttı. Etkisiz doz, 4 mg / kg idi; bu, mg / m2 bazında 24 mg / gün MRHD'nin 1.6 katıdır.
üst
Klinik çalışmalar
FANAPT'in şizofreni tedavisinde etkinliği 2 plasebo- ve aktif kontrollü kısa süreli (4 ve 6 haftalık) denemeler ve bir uzun süreli plasebo kontrollü randomize geri çekilme davası. Tüm denemeler, şizofreni için DSM-III / IV kriterlerini karşılayan hastaları içermiştir.
Bu çalışmalarda psikiyatrik belirti ve bulguları değerlendirmek için üç araç kullanılmıştır. Pozitif ve Negatif Sendrom Ölçeği (PANSS) ve Kısa Psikiyatrik Derecelendirme Ölçeği (BPRS), hem çok kalemli envanterlerdir.
genel psikopatolojinin genellikle şizofrenide ilaç tedavisinin etkilerini değerlendirmek için kullanılır. Klinik Global İzlenim (CGI) değerlendirmesi, şizofreninin tezahürlerine tamamen aşina olan yetenekli bir gözlemcinin hastanın genel klinik durumu hakkındaki izlenimini yansıtır.
6 haftalık, plasebo kontrollü bir çalışma (n = 706), plasebo ve aktif bir kontrole (risperidon) kıyasla 2 esnek doz FANAPT (12-16 mg / gün veya 20-24 mg / gün) içermiştir. 12-16 mg / gün grubu için FANAPT titrasyon programı, 1. ve 2. Günlerde günde iki kez 1 mg, 3. ve 4. Günlerde günde iki kez 2 mg, 5. ve 6. Günlerde günde iki kez 4 mg ve iki kez 6 mg idi. her gün 7.Gün. 20-24 mg / gün grubu için FANAPT titrasyon programı 1. Günde günde iki kez 1 mg, 2. Günde günde iki kez 2 mg, 3. günde günde iki kez 4 mg, 4. ve 5. günde günde iki kez 6 mg, 6. günde günde iki kez 8 mg ve 7. günde günde iki kez 10 mg. Birincil sonlanım noktası tedavinin sonunda BPRS toplam skorundaki taban çizgisinden değişmekteydi (42. Gün). Hem 12-16 mg / gün hem de 20-24 mg / gün FANAPT doz aralıkları, BPRS toplam skorunda plaseboya göre daha üstündü. Aktif kontrol antipsikotik ilacı, ilk 2 içinde bu çalışmada FANAPT'den daha üstün görünüyordu. haftalar, bunun için mümkün olan daha hızlı titrasyonla kısmen açıklanabilecek bir bulgu ilaç. Bu çalışmada en az 2 hafta tedavi gören hastalarda, iloperidonun aktif kontrol ile karşılaştırılabilir etkinliği olduğu görülmüştür.
4 haftalık plasebo kontrollü bir çalışma (n = 604), plasebo ve bir aktif kontrole (ziprasidon) kıyasla bir sabit doz FANAPT (24 mg / gün) içermiştir. Bu çalışmanın titrasyon programı, 6 haftalık çalışmanın titrasyon çizelgesine benzerdi. Bu çalışma, 1. Günde günde iki kez 1 mg'dan başlayıp 2, 3, 4, 5, 6 ve 7. Günlerde günde iki kez 2, 4, 6, 8, 10 ve 12 mg'a yükselen FANAPT titrasyonunu içeriyordu. Birincil sonlanım noktası, tedavi sonunda PANSS toplam skorundaki taban çizgisinden değişmekteydi (28. Gün). 24 mg / gün FANAPT dozu PANSS toplam skorunda plasebodan daha üstündü. FANAPT'nin aktif kontrol ilacı ile benzer bir etkiye sahip olduğu görülmüştür ki bu da hedef doza yavaş bir titrasyon gerektirir.
Uzun süreli bir çalışmada, klinik olarak stabil erişkin poliklinik hastaları (n = 303), 12 hafta sonra stabil kalan şizofreni için DSM-IV kriterlerini karşılamaktadır. esnek FANAPT dozları ile açık etiketli tedavi (8 mg / gün - günde iki kez 24 mg / gün), plaseboya veya devam etmek için randomize edildi. çift-kör nüksü sırasında olası nüksü gözlemlemek için mevcut FANAPT dozunu (8 mg / gün-24 mg / gün günde iki kez doz olarak uygulanır) önleme aşaması. Açık etiket fazı sırasında stabilizasyon, randomizasyondan önceki 4 haftadaki etkinlik nedeniyle değişmeyen, belirlenmiş bir FANAPT dozu üzerinde tanımlandı, CGI-Severity skoru ≤4 ve PANSS toplam skoru ≤70, aşağıdaki bireysel PANSS maddelerinin her birinde ≤4 skoru (P1-sanrıları, P2-kavramsal düzensizliği, P3-halüsinasyon davranışı, P6 şüphesi / zulmü, P7-düşmanlığı veya G8-işbirliği yapmama) ve hastaneye yatış veya tedavi için bakım seviyesinin artmaması alevlenmeler. Çift-kör nüksü önleme aşamasında nüks veya yaklaşan nüks, takip: şizofreninin kötüleşmesi, PANSS toplam skorunun artması (kötüleşmesi) nedeniyle hastaneye yatış ≥% 30, CGI-
İyileştirme skoru ≥6, hastada intihar, cinayet veya agresif davranış veya başka bir antipsikotik ilaca ihtiyaç vardı.

Ara analize dayanarak, bağımsız bir veri izleme komitesi, etkinlik kanıtı nedeniyle çalışmanın erken durdurulması gerektiğine karar vermiştir. Son analiz veri seti ile teyit edilen ara analiz sonuçlarına dayanarak, FANAPT, nüksetme veya nüksetme nüksü alan hastalara göre istatistiksel olarak daha uzun süre yaşadı Plasebo. Şekil 1, son veri setine göre nüks veya nükseden hastaların tahmini kümülatif oranını göstermektedir.
üst
Nasıl Sağlanır / Depolama ve Kullanım
FANAPT tabletler beyaz, yuvarlak ve bir tarafında debossed bir logo ve diğer tarafta tablet gücü “1”, “2”, “4”, “6”, “8”, “10” veya “12” ile tanımlanmıştır yan. Tabletler aşağıdaki güçlü yönlerde ve paket yapılandırmalarında sağlanır:
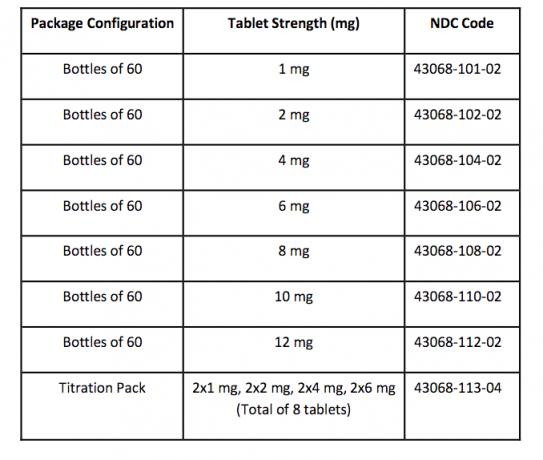
Depolama
FANAPT tabletlerini kontrollü oda sıcaklığında, 25 ° C (77 ° F) saklayın; 15 ° ila 30 ° C (59 ° ila 86 ° F) arası gezilere izin verilir [Bkz. USP Kontrollü Oda Sıcaklığı]. FANAPT tabletleri ışığa ve neme maruz kalmaktan koruyun.
HASTA DANIŞMANLIK BİLGİLERİ
Doktorlara FANAPT'yi reçete ettikleri hastalarla aşağıdaki konuları tartışmaları tavsiye edilir:
QT Aralığı Uzaması
Hastalara baygın hissettikleri, bilincini kaybettikleri veya kalp çarpıntısı varsa derhal doktorlarına danışmaları tavsiye edilmelidir. Hastalara QT aralığı uzamasına neden olan diğer ilaçlarla FANAPT kullanmamaları konusunda danışmanlık yapılmalıdır. Hastalara, yeni bir ilaç alınmadan önce doktorlara FANAPT kullandıklarını bildirmeleri söylenmelidir.
Nöroleptik Malign Sendrom
Hastalar ve bakıcılar potansiyel olarak ölümcül bir semptom kompleksinin bazen referans aldığı konusunda bilgilendirilmelidir. FANAPT dahil antipsikotik ilaçların uygulanması ile bağlantılı olarak NMS bildirilmiştir. NMS belirtileri ve semptomları arasında hiperpireksi, kas sertliği, değişen zihinsel durum ve otonomik kanıt bulunur
instabilite (düzensiz nabız veya kan basıncı, taşikardi, terleme ve kardiyak aritmi).
Metabolik Değişimler
Hastalar hiperglisemi (yüksek kan şekeri) ve diabetes mellitus semptomlarının farkında olmalıdır. Diyabet teşhisi konan hastalar, diyabet için risk faktörleri olanlar veya bunları geliştirenler tedavi sırasında ortaya çıkan semptomlar kan şekerinin başında ve sırasında periyodik olarak izlenmelidir. tedavisi. Hastalara FANAPT tedavisi sırasında kilo alımının meydana geldiği konusunda danışmanlık yapılmalıdır. Ağırlığın klinik olarak izlenmesi önerilir.
Ortostatik hipotansiyon
Hastalara, özellikle tedaviyi başlatırken, tedaviyi yeniden başlatırken veya dozu arttırırken, ortostatik hipotansiyon riski konusunda uyarılmalıdır.
Bilişsel ve Motor Performansına Müdahale
FANAPT, yargı, düşünme veya motor becerileri bozma potansiyeline sahip olabileceğinden, hastalar hakkında dikkatli olunmalıdır. FANAPT tedavisinin kendilerini etkilemediğinden emin oluncaya kadar otomobiller de dahil olmak üzere tehlikeli makinelerin çalıştırılması olumsuz olarak.
Gebelik
Hastalara üçüncü trimester Fanapt kullanımının yenidoğanda ekstrapiramidal ve / veya yoksunluk semptomlarına neden olabileceğini söyleyin. Hastalara bilinen veya şüpheli hamileliklerini sağlık uzmanlarına bildirmelerini söyleyin.
Hamilelik Kaydı
Hastalara, hamilelik sırasında FANAPT'a maruz kalan kadınlarda hamilelik sonuçlarını izleyen bir hamilelik maruziyeti kaydının olduğunu söyleyin
emzirme
Kadınlara FANAPT tedavisi sırasında emzirmemelerini söyleyin.
Eşzamanlı İlaç
Etkileşim potansiyeli olduğundan, reçeteli veya reçetesiz satılan ilaçları alıp almayı veya almayı planlıyorlarsa, hastalara doktorlarını bilgilendirmeleri tavsiye edilmelidir.
Alkol
Hastalara FANAPT alırken alkolden kaçınmaları tavsiye edilmelidir.
Isıya Maruz Kalma ve Dehidrasyon
Aşırı ısınma ve dehidrasyondan kaçınmak için hastalara uygun bakım konusunda bilgilendirilmelidir.
Tarafından dağıtıldı:
Vanda İlaç A.Ş.
Washington, D.C. 20037 ABD
Vanda ve Fanapt®, Vanda Pharmaceuticals Inc. şirketinin tescilli ticari markalarıdır. ABD ve diğer ülkelerde.
başa dönüş
Fanapt (Iloperidon) Reçete Yazma Rehberi (PDF)
Bu monograftaki bilgilerin olası tüm kullanımları, talimatları, önlemleri, ilaç etkileşimlerini veya yan etkileri kapsaması amaçlanmamıştır. Bu bilgiler genelleştirilmiştir ve özel tıbbi tavsiye olarak tasarlanmamıştır. Aldığınız ilaçlar hakkında sorularınız varsa veya daha fazla bilgi edinmek istiyorsanız, doktorunuza, eczacınıza veya hemşirenize danışın.
son güncelleme 07/13
geri dön: Psikiyatrik İlaçlar Farmakoloji



