Namenda: Alzheimer İlaçları
Namenda, Alzheimer Hastalığının tedavisinde kullanılan bir ilaçtır. Namenda'nın kullanımı, dozu, yan etkileri hakkında ayrıntılı bilgi.
Marka Adı: Namenda
Jenerik Adı: Memantin hidroklorür
Namenda (memantin hidroklorür), Alzheimer Hastalığının tedavisinde kullanılan bir ilaçtır. Namenda kullanımları, dozu ve yan etkileri hakkında ayrıntılı bilgi
İçindekiler:
Açıklama
Farmakoloji
Göstergeler ve kullanımları
Kontrendikasyonlar
Önlemler
İlaç etkileşimleri
Ters tepkiler
aşırı doz
Dozaj
Sağlanan
Hasta Talimatları
Namenda Hasta Bilgileri (normal İngilizce)
Açıklama
Namenda® (memantin hidroklorür) oral olarak aktif bir NMDA reseptör antagonistidir. Memantin hidroklorürün kimyasal adı, aşağıdaki yapısal formüle sahip 1-amino-3,5-dimetiladamantan hidroklorürdür:
Kaynak: Forest Laboratories, ABD distribütörü veya Namenda.
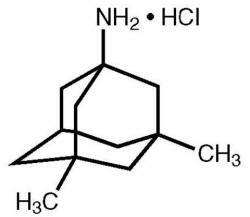
Moleküler formül C12H21N-HCl'dir ve molekül ağırlığı 215.76'dır.
Memantin HC1, ince beyaz ila kirli beyaz bir toz halinde oluşur ve suda çözünür. Namenda tabletler veya oral bir çözelti olarak mevcuttur. Namenda, 5 mg ve 10 mg memantin hidroklorür içeren kapsül şeklinde, film kaplı tabletler halinde oral uygulama için kullanılabilir. Tabletler ayrıca aşağıdaki aktif olmayan bileşenleri içerir: mikrokristalin selüloz, laktoz monohidrat, kolloidal silikon dioksit, talk ve magnezyum stearat. Ek olarak, film kaplamasının bileşenleri olarak aşağıdaki aktif olmayan bileşenler de bulunur: hipromelloz, triasetin, titanyum dioksit, FD&C sarı # 6 ve FD&C mavi # 2 (5 mg tablet), demir oksit siyahı (10 mg tablet). Namenda oral çözeltisi, her mL'de 2 mg memantin hidroklorüre eşdeğer bir mukavemette memantin hidroklorür içerir. Oral çözelti ayrıca aşağıdaki aktif olmayan bileşenleri içerir: sorbitol çözeltisi (% 70), metil paraben, propilparaben, propilen glikol, gliserin, doğal nane aroması # 104, sitrik asit, sodyum sitrat ve saflaştırılmış Su.
Klinik Farmakoloji
Etki Mekanizması ve Farmakodinamiği
Merkezi sinir sistemi N-metil-D-aspartat (NMDA) reseptörlerinin uyarıcı amino asit glutamatın, semptomatolojisine katkıda bulunduğu varsayılmıştır. Alzheimer hastalığı. Memantin, düşük ila orta afinite olarak eylemi yoluyla terapötik etkisini gösterdiği varsayılır. tercihen NMDA reseptörü tarafından işletilen rekabete açık olmayan (açık kanal) NMDA reseptör antagonisti katyon kanalları. Memantinin Alzheimer hastalığı olan hastalarda nörodejenerasyonu önlediğine veya yavaşlattığına dair bir kanıt yoktur.
Memantin GABA, benzodiazepin, dopamin, adrenerjik, histamin ve glisin reseptörleri ve voltaja bağlı Ca2 +, Na + veya K + kanalları için düşük ila ihmal edilebilir afinite göstermiştir. Memantin ayrıca 5HT3 reseptöründe benzer bir potansiyele sahip antagonistik etkiler gösterdi. NMDA reseptörü ve altıda bir ila onuncu arasında bir oranda bloke edilmiş nikotinik asetilkolin reseptörleri potens.
İn vitro çalışmalar memantinin donepezil, galantamin veya takrin tarafından geri dönüşümlü asetilkolinesteraz inhibisyonunu etkilemediğini göstermiştir.
Farmakokinetik
Memantin, oral uygulamadan sonra iyi emilir ve terapötik doz aralığında doğrusal farmakokinetiğe sahiptir. Ağırlıklı olarak idrarla atılır, değişmez ve terminal eliminasyon yarı ömrü yaklaşık 60-80 saattir.
Emilim ve Dağıtım
Oral uygulamayı takiben memantin, yaklaşık 3-7 saat içinde ulaşılan pik konsantrasyonlarla yüksek oranda emilir. Yiyeceklerin memantin emilimi üzerinde hiçbir etkisi yoktur. Memantinin ortalama dağılım hacmi 9-11 L / kg'dır ve plazma proteinlerine bağlanma düşüktür (% 45).
Metabolizma ve Eliminasyon
Memantin kısmi hepatik metabolizmaya uğrar. Uygulanan ilacın yaklaşık% 48'i değişmeden idrarla atılır; geri kalan, öncelikle minimal NMDA reseptörüne sahip olan üç polar metabolite dönüştürülür antagonistik aktivite: N-glukuronid konjugatı, 6-hidroksi memantin ve 1-nitrozo-deamine memantin. Uygulanan dozun toplam% 74'ü ana ilacın ve N-glukuronid konjügatının toplamı olarak atılır. Karaciğer mikrozomal CYP450 enzim sistemi memantin metabolizmasında önemli bir rol oynamaz. Memantin, yaklaşık 60-80 saatlik bir terminal eliminasyon yarı ömrüne sahiptir. Renal klerens, pH'a bağlı tübüler reabsorpsiyon ile kontrol edilen aktif tübüler sekresyonu içerir.
Özel Nüfuslar
Böbrek yetmezliği: Memantin farmakokinetiği, hafif böbrek yetmezliği olan 8 olguda 20 mg memantin HCl'nin tek oral uygulanmasının ardından değerlendirildi (kreatinin klerensi, CLcr,> 50-80 mL / dak), orta derecede böbrek yetmezliği olan 8 olgu (CLcr 30-49 mL / dak), ciddi böbrek yetmezliği olan 7 olgu (CLcr 5 - 29 mL / dak) ve 8 sağlıklı birey (CLcr> 80 mL / dak) böbrek hastalarına yaş, ağırlık ve cinsiyete göre mümkün olduğunca yakın bozukluğu. Ortalama AUC 0- (sonsuz), hafif, orta ve şiddetli böbrek yetmezliği olan hastalarda sağlıklı deneklere göre sırasıyla% 4,% 60 ve% 115 artmıştır. Hafif, orta ve şiddetli böbrek yetmezliği olan hastalarda terminal eliminasyon yarılanma ömrü, sağlıklı deneklere göre sırasıyla% 18,% 41 ve% 95 artmıştır.
Hafif ve orta derecede böbrek yetmezliği olan hastalar için doz ayarlaması önerilmez. Şiddetli böbrek yetmezliği olan hastalarda doz azaltılmalıdır (Bkz. DOZAJ VE YÖNETİM).
yaşlı: Namenda'nın genç ve yaşlı kişilerde farmakokinetiği benzerdir.
Cinsiyet: Namenda 20 mg b.i.d.'nin çoklu doz uygulamasını takiben, dişilerin erkeklerden yaklaşık% 45 daha yüksek maruziyeti vardı, ancak vücut ağırlığı dikkate alındığında maruziyette hiçbir fark yoktu.
İlaç-İlaç Etkileşimleri
Mikrozomal Enzimlerin Substratları: İn vitro çalışmalar, etkililikle ilişkili olanları aşan konsantrasyonlarda memantin sitokrom P450 izoenzimleri CYP1A2, CYP2C9, CYP2E1 ve CYP3A4 / 5'i indüklemediğini göstermiştir. Ek olarak, in vitro çalışmalar memantinin CYP450 enzimleri CYP1A2, CYP2A6, CYP2C9, CYP2D6, CYP2E1 ve CYP3A4'ün minimal inhibisyonunu ürettiğini göstermiştir. Bu veriler, bu enzimler tarafından metabolize edilen ilaçlarla herhangi bir farmakokinetik etkileşimin beklenmediğini göstermektedir.
Mikrozomal Enzimlerin İnhibitörleri: Memantin, minimal metabolizmaya maruz kaldığından, dozun çoğunluğu idrarda değişmeden atılır, memantin ile CYP450 enzimlerinin inhibitörleri olan ilaçlar arasında bir etkileşim olasılığı düşüktür. Namenda'nın AChE inhibitörü donepezil HC1 ile birlikte uygulanması, her iki bileşiğin farmakokinetiğini etkilemez.
Böbrek Mekanizmaları ile Ortadan Kaldırılan İlaçlar: Memantin kısmen tübüler sekresyon ile elimine edilir. In vivo çalışmalar, çoklu dozlarda diüretik hidroklorotiyazid / triamterenin (HCTZ / TA), memantinin AUC'sini sabit durumda etkilemediğini göstermiştir. Memantin, TA'nın biyoyararlanımını etkilemedi ve AUC ve Cmaks HCTZ'yi yaklaşık% 20 azalttı. Memantinin antihiperglisemik ilaç Glucovance® (gliburid ve metformin HC1) ile birlikte uygulanması, memantin, metformin ve gliburitin farmakokinetiğini etkilememiştir. Memantin, Glucovance®'in serum glikoz düşürücü etkilerini değiştirmedi, bu da farmakodinamik etkileşimin olmadığını gösterdi.
İdrarı alkalin yapan ilaçlar: Memantin klerensi, pH 8'de alkalin idrar koşulları altında yaklaşık% 80 azaltıldı. Bu nedenle, idrar pH'sının alkalin durumuna doğru değişmesi, ilacın birikimine yol açabilir ve bu da yan etkilerde olası bir artışa neden olabilir. İdrarı alkalileştiren ilaçların (örneğin karbonik anhidraz inhibitörleri, sodyum bikarbonat) memantinin renal eliminasyonunu azaltması beklenir.
Plazma proteinlerine yüksek oranda bağlı ilaçlar: Memantinin plazma proteinlerine bağlanması düşük olduğu için (% 45), varfarin ve digoksin gibi plazma proteinlerine yüksek oranda bağlanan ilaçlarla etkileşimi düşüktür.
KLİNİK DENEMELER
Namenda'nın (memantin hidroklorür) orta ila şiddetli Alzheimer hastalığı olan hastalar için bir tedavi olarak etkinliği 2 randomize, Birleşik Devletler'de hem bilişsel hem de günlük işlevi değerlendiren çift kör, plasebo kontrollü klinik çalışmalar (Çalışma 1 ve 2). Bu iki araştırmaya katılan hastaların yaş ortalaması 76-50-93 yıl idi. Hastaların yaklaşık% 66'sı kadın,% 91'i beyazdı.
Letonya'da yapılan üçüncü bir çalışma (Çalışma 3) ağır demans hastalarını kaydettirdi, ancak bilişsel işlevi planlanan bir son nokta olarak değerlendirmedi.
Çalışma Sonucu Önlemleri: Her bir ABD çalışmasında, Namenda'nın etkinliği her iki araç kullanılarak da belirlenmiştir. bakıcıyla ilgili değerlendirme yoluyla genel işlevi değerlendirmek için tasarlanmış ve ölçen bir araç biliş. Her iki çalışma, Namenda'daki hastaların plaseboya kıyasla her iki ölçümde de önemli iyileşme yaşadıklarını gösterdi.
Her iki çalışmada da günlük fonksiyon, değiştirilmiş Alzheimer hastalığı Kooperatif Çalışması - Günlük Yaşam envanteri (ADCS-ADL) kullanılarak değerlendirildi. ADCS-ADL, hastaların fonksiyonel yeteneklerini ölçmek için kullanılan kapsamlı bir ADL soruları pilinden oluşur. Her bir ADL kalemi, en yüksek bağımsız performans seviyesinden tam kayıplara kadar derecelendirilir. Araştırmacı, hastanın davranışını bilen bir bakıcıyla görüşerek envanteri gerçekleştirir. Hastanın yemek, giyinme, yıkanma, telefon, seyahat, alışveriş, ve diğer ev işlerini yapmak orta ila şiddetli hastaların değerlendirilmesi için onaylanmıştır demans. Bu, 0 ila 54 arasında bir puanlama aralığına sahip olan modifiye edilmiş ADCS-ADL'dir ve daha düşük puanlar daha fazla fonksiyonel bozukluğu gösterir.
Namenda'nın bilişsel performansı iyileştirme kabiliyeti, her iki çalışmada da Şiddetli Bozukluk Bataryası (SIB) ile değerlendirildi. orta ila şiddetli hastalarda bilişsel işlevin değerlendirilmesi için doğrulanmış çok maddeli alet demans. SIB, dikkat, yönelim, dil, bellek, görsel-uzamsal yetenek, inşaat, uygulama ve sosyal etkileşim unsurları dahil olmak üzere bilişsel performansın seçilen yönlerini inceler. SIB puanlama aralığı 0 ila 100 arasındadır ve daha düşük puanlar daha fazla bilişsel bozukluğu gösterir.
Çalışma 1 (Yirmi Sekiz Haftalık Çalışma)
28 haftalık bir çalışmada, orta ila şiddetli olası Alzheimer hastalığı olan 252 hasta (DSM-IV ve NINCDS-ADRDA tanısı) Mini-Mental Durum Sınav puanları> / = 3 ve! - = 14 ve Global Bozulma Ölçeği Aşama 5-6) ile Namenda veya Plasebo. Namenda'ya randomize edilen hastalar için, tedavi günde bir kez 5 mg'da başlatıldı ve haftada 5 mg / gün bölünmüş dozlarla 20 mg / gün (günde iki kez 10 mg) bir doza yükseltildi.
ADCS-ADL üzerindeki etkiler:
Şekil 1, çalışmanın 28 haftasını tamamlayan iki tedavi grubundaki hastalar için ADCS-ADL skorundaki taban çizgisinden değişim için zaman sürecini göstermektedir. 28 haftalık tedavide, Namenda ile tedavi edilen hastalar için ADCS-ADL değişim skorlarındaki plasebo hastalarına göre ortalama fark 3.4 birimdir. Tüm hastalara dayanan bir analiz kullanarak ve son çalışma gözlemlerini ileriye taşıyan (LOCF analizi), Namenda tedavisi plasebodan istatistiksel olarak anlamlı derecede üstündü.
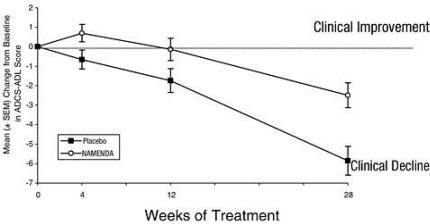
Şekil 1: 28 haftalık tedaviyi tamamlayan hastalar için ADCS-ADL skorundaki başlangıçtan değişimin zaman süreci.
Şekil 2, en azından X ekseninde gösterilen ADCS-ADL değişikliğine ulaşmış olan tedavi gruplarının her birindeki hastaların kümülatif yüzdelerini göstermektedir.
Eğriler, hem Namenda'ya hem de plaseboya atanan hastaların çok çeşitli yanıtlara sahip olduğunu ve genellikle bozulma gösterdiğini göstermektedir (a ADCS-ADL'de taban çizgisine göre negatif değişiklik), ancak Namenda grubunun daha küçük bir düşüş veya Gelişme. (Kümülatif dağılım göstergesinde, etkili bir tedavi için bir eğri, aşağıdakiler için eğrinin soluna kaydırılır: plasebo, etkisiz veya zararlı bir tedavi için eğrinin üzerine bindirilir veya eğrinin sağına kaydırılır. plasebo).

Şekil 2: ADCS-ADL skorlarında taban çizgisinden belirli değişiklikler ile 28 haftalık çift kör tedaviyi tamamlayan hastaların kümülatif yüzdesi.
SIB üzerindeki etkiler: Şekil 3, çalışmanın 28 haftası boyunca iki tedavi grubu için SIB skorundaki taban çizgisinden değişim için zaman sürecini göstermektedir. 28 haftalık tedavide, Namenda ile tedavi edilen hastalar için plasebo alan hastalara kıyasla SIB değişim skorlarındaki ortalama fark 5.7 ünitedir. Bir LOCF analizi kullanarak, Namenda tedavisi plasebodan istatistiksel olarak anlamlı derecede üstündü.

Şekil 3: 28 haftalık tedaviyi tamamlayan hastalar için SIB skorundaki taban çizgisinden değişimin zaman süreci.
Şekil 4, her bir tedavi grubundan, X ekseninde gösterilen SIB skorundaki değişiklik ölçüsüne ulaşmış olan hastaların kümülatif yüzdelerini göstermektedir.
Eğriler, hem Namenda'ya hem de plaseboya atanan hastaların çok çeşitli yanıtlara sahip olduğunu ve genellikle bozulma gösterir, ancak Namenda grubunun daha küçük bir düşüş veya Gelişme.
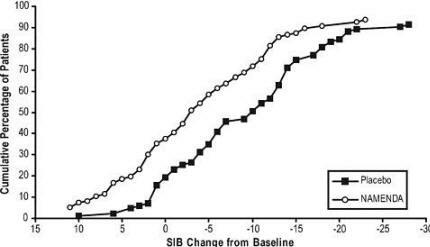
Şekil 4: SIB skorlarında taban çizgisinden belirli değişiklikler ile 28 haftalık çift kör tedaviyi tamamlayan hastaların kümülatif yüzdesi.
Çalışma 2 (Yirmi Dört Haftalık Çalışma) 24 haftalık bir çalışmada, orta ila şiddetli 404 hasta olası Alzheimer hastalığı (NINCDS-ADRDA kriterleri ile teşhis, Mini-Mental Durum Muayenesi ile Skorlar ≥ 5 ve ≤ 14) Donepezil ile en az 6 aydır tedavi gören ve son 3 ay boyunca donepezil, hala alırken Namenda veya plaseboya randomize edildi Donepezil. Namenda'ya randomize edilen hastalar için tedaviye günde bir kez 5 mg'da başlandı ve haftada 5 mg / gün bölünmüş dozlarda 20 mg / gün (günde iki kez 10 mg) bir doza yükseltildi.
ADCS-ADL üzerindeki etkiler: Şekil 5, çalışmanın 24 haftası boyunca iki tedavi grubu için ADCS-ADL skorunda taban çizgisinden değişiklik için zaman sürecini göstermektedir. 24 haftalık tedavide, ADCS-ADL'deki ortalama fark Namenda / donepezil için skorları değiştirir tedavi edilen hastalar (kombinasyon tedavisi) plasebo / donepezil (monoterapi) hastalarına kıyasla 1,6 birimleri. Bir LOCF analizi kullanarak, Namenda / donepezil tedavisi plasebo / donepezil'den istatistiksel olarak anlamlı derecede üstündü.

Şekil 5: 24 haftalık tedaviyi tamamlayan hastalar için ADCS-ADL skorundaki başlangıçtan değişimin zaman süreci.
Şekil 6, X ekseninde gösterilen ADCS-ADL'de en azından gelişme ölçüsüne erişmiş olan her bir tedavi grubundan hastaların toplam yüzdelerini göstermektedir.
Eğriler, hem Namenda / donepezil'e hem de plasebo / donepezil'e atanan hastaların çok çeşitli yanıtlara sahip olduğunu ve genellikle bozulma gösterir, ancak Namenda / donepezil grubunun daha küçük bir düşüş veya Gelişme.

Şekil 6: ADCS-ADL skorlarında taban çizgisinden belirli değişiklikler ile 24 haftalık çift kör tedaviyi tamamlayan hastaların kümülatif yüzdesi.
SIB üzerindeki etkiler: Şekil 7, çalışmanın 24 haftası boyunca iki tedavi grubu için SIB skorundaki taban çizgisinden değişimin zaman sürecini göstermektedir. 24 haftalık tedavide, Namenda / donepezil ile tedavi edilen hastalar için plasebo / donepezil hastalarına kıyasla SIB değişim skorlarındaki ortalama fark 3.3 birimdir. Bir LOCF analizi kullanarak, Namenda / donepezil tedavisi plasebo / donepezil'den istatistiksel olarak anlamlı derecede üstündü.

Şekil 7: 24 haftalık tedaviyi tamamlayan hastalar için SIB skorundaki başlangıçtan değişimin zaman süreci.
Şekil 8, her bir tedavi grubundan, X ekseninde gösterilen SIB skorunda en azından iyileşme ölçüsüne ulaşmış olan hastaların kümülatif yüzdelerini göstermektedir.
Eğriler Namenda / donepezil ve plasebo / donepezil'e atanan hastaların geniş bir yelpazeye sahip olduğunu göstermektedir. ancak Namenda / donepezil grubunun bir gelişme veya daha küçük bir gelişme gösterme olasılığı daha yüksektir reddedin.

Şekil 8: SIB skorlarında taban çizgisinden belirli değişiklikler ile 24 haftalık çift kör tedaviyi tamamlayan hastaların kümülatif yüzdesi.
Çalışma 3 (On İki Haftalık Çalışma) Letonya'daki huzurevlerinde yürütülen 12 haftalık süreli çift kör bir çalışmada, demansı olan 166 hasta DSM-III-R, Mini-Mental Durum Muayene skoru <10 ve Global Bozulma Ölçeği evrelendirmesi 5 ila 7 arasında Namenda veya Plasebo. Namenda'ya randomize edilen hastalar için tedaviye günde bir kez 5 mg'da başlandı ve 1 hafta sonra günde bir kez 10 mg'a çıkarıldı. Birincil etkinlik ölçütleri, Geriatrik Hastalarda Davranış Derecelendirme Ölçeğinin bakım bağımlılığı alt ölçeğidir. (BGP), günlük fonksiyonun bir ölçüsü ve genel bir klinik ölçümün Klinik Küresel Değişim İzlenimi (CGI-C) etki. Bu çalışmada geçerli bir bilişsel işlev ölçütü kullanılmamıştır. 12. haftada plaseboya göre Namenda'yı tercih eden istatistiksel olarak anlamlı bir tedavi farkı, her iki birincil etkililik ölçümünde de görülmüştür. Girilen hastalar Alzheimer hastalığı ve vasküler demansın bir karışımı olduğundan, iki grubu ve tümünü ayırt etmek için girişimde bulunuldu. hastalar daha sonra çalışmadaki Hachinski İskemik Ölçeği'ndeki puanlarına dayanarak vasküler demans veya Alzheimer hastalığı olarak tanımlandı. girişi. Hastaların sadece% 50'sinde bilgisayarlı beyin tomografisi vardı. Alzheimer hastalığı olduğu belirlenen alt kümede hem BGP hem de CGI-C'de 12. haftada Namenda'yı plasebo üzerine tercih eden istatistiksel olarak anlamlı bir tedavi etkisi görülmüştür.
Göstergeler ve kullanımları
Namenda (memantin hidroklorür), Alzheimer tipinin orta ila şiddetli demansının tedavisi için endikedir.
Kontrendikasyonlar
Namenda (memantin hidroklorür), memantin hidroklorüre veya formülasyonda kullanılan herhangi bir eksipiyana karşı aşırı duyarlılığı olduğu bilinen hastalarda kontrendikedir.
Önlemler
Hastalar ve Bakıcılar için Bilgiler: Bakıcılar, önerilen uygulamada (5 mg'ın üzerindeki dozlar için günde iki kez) ve doz artışına (doz artışları arasında en az bir haftalık aralık) talimat verilmelidir.
Nörolojik Durumlar Nöbetler:
Namenda, nöbet bozukluğu olan hastalarda sistematik olarak değerlendirilmemiştir. Namenda'nın klinik çalışmalarında, Namenda ile tedavi edilen hastaların% 0.2'sinde ve plasebo ile tedavi edilen hastaların% 0.5'inde nöbetler meydana geldi.
Genitoüriner Koşullar
İdrar pH'sını yükselten koşullar memantinin üriner eliminasyonunu azaltarak memantin plazma seviyelerinin yükselmesine neden olabilir.
Özel Nüfuslar
Karaciğer yetmezliği
Namenda kısmi hepatik metabolizmaya uğrar, uygulanan dozun yaklaşık% 48'i değişmemiş ilaç olarak veya ana ilaç ve N-glukuronid konjugatının toplamı (% 74) olarak idrarla atılır. Karaciğer yetmezliği olan hastalarda memantin farmakokinetiği araştırılmamıştır, ancak sadece hafifçe etkilenmesi beklenmektedir.
Böbrek yetmezliği
Hafif veya orta derecede böbrek yetmezliği olan hastalarda doz ayarlamasına gerek yoktur. Şiddetli böbrek yetmezliği olan hastalarda dozun azaltılması önerilir (bkz. KLİNİK FARMAKOLOJİ ve KULLANIM ŞEKLİ VE DOZU ).
İlaç-İlaç Etkileşimleri
N-metil-D-aspartat (NMDA) antagonistler: Namenda'nın diğer NMDA antagonistleri (amantadin, ketamin ve dekstrometorfan) ile kombine kullanımı sistematik olarak değerlendirilmemiştir ve bu kullanıma dikkatle yaklaşılmalıdır.
Namenda'nın mikrozomal enzimlerin substratları üzerine etkileri: CYP450 enzimlerinin (CYP1A2, -2A6, -2C9, -2D6, -2E1, -3A4) marker substratları ile yapılan in vitro çalışmalar, bu enzimlerin memantin tarafından minimal inhibisyonu gösterdi. Ek olarak, in vitro çalışmalar, etkinlikle ilişkili olanları aşan konsantrasyonlarda memantinin sitokrom P450 izoenzimleri CYP1A2, CYP2C9, CYP2E1 ve CYP3A4 / 5'i indüklemediğini göstermektedir. Bu enzimler tarafından metabolize edilen ilaçlarla herhangi bir farmakokinetik etkileşim beklenmemektedir.
Mikrozomal enzimlerin inhibitörlerinin ve / veya substratlarının Namenda üzerindeki etkileri: Memantin ağırlıklı olarak böbreklerden atılır ve CYP450 sisteminin substratları ve / veya inhibitörleri olan ilaçların memantin metabolizmasını değiştirmesi beklenmez.
Asetilkolinesteraz (AChE) inhibitörleri: Namenda'nın AChE inhibitörü donepezil HC1 ile birlikte uygulanması, her iki bileşiğin farmakokinetiğini etkilemedi. Orta ila şiddetli Alzheimer hastalığı olan hastalarda 24 haftalık kontrollü bir klinik çalışmada, memantin ve donepezil kombinasyonu ile gözlenen olay profili sadece donepezilinkine benzerdi.
Böbrek mekanizmaları ile atılan ilaçlar: Memantin kısmen tübüler sekresyon ile ortadan kaldırıldığı için, aynı renal katyonik sistemi kullanan ilaçların birlikte uygulanması, hidroklorotiyazid (HCTZ), triamteren (TA), metformin, simetidin, ranitidin, kinidin ve nikotin potansiyel olarak plazma seviyelerinin değişmesine neden olabilir her iki ajanın. Bununla birlikte, Namenda ve HCTZ / TA'nın birlikte uygulanması memantin veya TA'nın biyoyararlanımını etkilemedi ve HCTZ'nin biyoyararlanımı% 20 azaldı. Ek olarak, memantinin antihiperglisemik ilaç Glucovance® (gliburid ve metformin HCl) ile birlikte uygulanması, memantin, metformin ve gliburidin farmakokinetiğini etkilememiştir. Ayrıca memantin, Glucovance®'in serum glikoz düşürücü etkisini değiştirmedi.
İdrarı alkalin yapan ilaçlar: Memantin klerensi, pH 8'de alkalin idrar koşulları altında yaklaşık% 80 azaltıldı. Bu nedenle, idrar pH'sının alkalin durumuna doğru değişmesi, ilacın birikmesinde, yan etkilerin olası bir artışıyla sonuçlanabilir. İdrar pH'ı diyet, ilaçlar (örn. Karbonik anhidraz inhibitörleri, sodyum bikarbonat) ve hastanın klinik durumu (örn. Renal tübüler asidoz veya idrar yollarının ciddi enfeksiyonları) ile değiştirilir. Bu nedenle, memantin bu koşullar altında dikkatle kullanılmalıdır.
Karsinogenez, Mutajenez ve Doğurganlığın Bozulması
Farelerde 113 mg'lık bir oral çalışmada 40 mg / kg / gün'e kadar olan dozlarda (mg / m2 bazında önerilen maksimum insan dozunun [MRHD] 10 katı) herhangi bir karsinojenite kanıtı yoktu. 71 hafta boyunca 40 mg / kg / güne kadar oral yoldan dozlanan sıçanlarda da kanserojenite kanıtı yoktu. ardından 128 hafta boyunca 20 mg / kg / gün (mg / m2 bazında sırasıyla MRHD'nin 20 ve 10 katı).
Memantin, in vitro S'de değerlendirildiğinde genotoksik potansiyel kanıtı üretmedi. typhimurium veya E. coli ters mutasyon deneyi, insan lenfositlerinde in vitro kromozomal sapma testi, sıçanlarda kromozom hasarı için in vivo sitogenetik deneyi ve in vivo fare mikronükleus deneyi. Sonuçlar, Çin hamsteri V79 hücreleri kullanılarak bir in vitro gen mutasyon tahlilinde eş anlamlıydı.
18 mg / kg / gün'e kadar uygulanan sıçanlarda doğurganlık veya üreme performansında herhangi bir bozulma görülmemiştir ( mg / m2 bazında) kadınlarda gebelik ve emzirme yoluyla çiftleşmeden 14 gün önce veya çiftleşmeden 60 gün önce oral yoldan erkekler.
Gebelik
Gebelik Kategorisi B: Organogenez döneminde hamile sıçanlara ve hamile tavşanlara oral olarak verilen memantin, test edilen en yüksek dozlara kadar teratojenik değildi (Sıçanlarda 18 mg / kg / gün ve tavşanlarda 30 mg / kg / gün, bunlar sırasıyla 9 ve 30 kez, bir mg / m2 üzerinde önerilen maksimum insan dozu [MRHD] temeli).
Ağızda hafif maternal toksisite, azalan yavru ağırlıkları ve kemikleşmemiş servikal vertebra insidansında artış sıçanlara çiftleşme öncesi ve doğum sonrası devam eden oral memantin verilen bir çalışmada 18 mg / kg / gün doz dönem. Bu dozda sıçanların doğumdan sonraki 15. günden itibaren tedavi sonrası yapılan bir çalışmada da hafif maternal toksisite ve azalan yavru ağırlıkları görülmüştür. Bu etkiler için etkisiz doz, 6 mg / kg idi; bu, mg / m2 bazında MRHD'nin 3 katıdır.
Gebe kadınlarda memantin ile ilgili yeterli ve iyi kontrol edilmiş bir çalışma yoktur. Memantin hamilelik sırasında sadece potansiyel fayda fetusun potansiyel riskini haklı çıkarsa kullanılmalıdır.
Emziren Anneler
Memantinin anne sütüne geçip geçmediği bilinmemektedir. Birçok ilaç anne sütüne geçtiği için emziren bir anneye memantin uygulandığında dikkatli olunmalıdır.
Pediyatrik Kullanım
Çocuklarda meydana gelen herhangi bir hastalıkta memantin güvenliğini ve etkinliğini belgeleyen yeterli ve iyi kontrollü bir çalışma yoktur.
Ters tepkiler
Bu bölümde açıklanan deneyim, Alzheimer hastalığı ve vasküler demansı olan hastalarda yapılan çalışmalardan kaynaklanmaktadır.
Durdurulan Yan EtkilerDemans hastalarının günde 20 mg'a kadar Namenda dozları aldığı plasebo kontrollü çalışmalarda, Namenda grubunda plaseboda olduğu gibi olumsuz bir olay nedeniyle kesilme olasılığı aynıydı grubudur. Namenda ile tedavi edilen hastaların% 1 veya daha fazlasında ve plasebodan daha yüksek bir oranda tedavinin kesilmesi ile ilgili bireysel advers olay görülmemiştir.
Kontrollü Araştırmalarda Bildirilen Olumsuz Olaylar: Namenda (memantin hidroklorür) çalışmalarında bildirilen advers olaylar, yüksek oranda seçilmiş hasta popülasyonunda yakından izlenen koşullar altında kazanılan deneyimleri yansıtmaktadır. Gerçek uygulamada veya diğer klinik çalışmalarda, kullanım koşulları, raporlama davranışı ve tedavi edilen hasta tipleri farklı olabileceğinden, bu frekans tahminleri geçerli olmayabilir. Tablo 1, plasebo kontrollü hastaların en az% 2'sinde bildirilen tedaviye bağlı belirti ve semptomları listelemektedir Demans denemeleri ve Namenda ile tedavi edilen hastalarda görülme oranı, tedavi edilenlere göre daha fazla olan Plasebo. Plasebo oranının en az% 5'i ve iki katı sıklıkta hiçbir olumsuz olay meydana gelmemiştir.
Vücut sistemi |
plasebo (N = 922) % |
Namenda (N = 940) % |
Bir bütün olarak beden | ||
yorgunluk |
1 | 2 |
Ağrı |
1 | 3 |
Kardiyovasküler sistem | ||
Hipertansiyon |
2 | 4 |
Merkezi ve Periferik Sinir Sistemi | ||
Baş dönmesi |
5 | 7 |
Baş ağrısı |
3 | 6 |
Mide bağırsak sistemi | ||
Kabızlık |
3 | 5 |
Kusma |
2 | 3 |
Kas-İskelet Sistemi | ||
Sırt ağrısı |
2 | 3 |
Psikolojik bozukluklar | ||
karışıklık |
5 | 6 |
uyuklama |
2 | 3 |
sanrı |
2 | 3 |
Solunum sistemi | ||
Öksürme |
3 | 4 |
solunum güçlüğü |
1 | 2 |
Namenda ile tedavi edilen hastalarda en az% 2 oranında görülen, ancak plaseboda daha yüksek veya eşit oranda meydana gelen diğer advers olaylar ajitasyon, düşme, zedelenmiş yaralanma, idrar tutamama, ishal, bronşit, uykusuzluk, idrar yolu enfeksiyonu, grip benzeri semptomlar, anormal yürüyüş, depresyon, üst solunum yolu enfeksiyonu, anksiyete, periferik ödem, bulantı, anoreksi ve eklem ağrıları.
Olumsuz olayların genel profili ve alt hastaların popülasyonunda bireysel advers olayların insidans oranları orta ila şiddetli Alzheimer hastalığı yukarıda genel demans için tanımlanan profil ve insidans oranlarından farklı değildi nüfus.
Hayati İşaret Değişiklikleri: Namenda ve plasebo grupları (1) yaşamsal belirtilerde (nabız, sistolik kan basıncı, diyastolik kanda başlangıçtan ortalama değişim) karşılaştırıldı. basınç ve ağırlık) ve (2) bunlarda taban çizgisinden potansiyel olarak klinik olarak önemli değişiklikler için kriterleri karşılayan hastaların görülme sıklığı değişkenler. Namenda ile tedavi edilen hastalarda yaşamsal belirtilerde klinik olarak önemli bir değişiklik olmamıştır. Yaşlı normal bireylerde Namenda ve plasebo için sırtüstü ve ayakta duran hayati işaret ölçümlerinin karşılaştırılması, Namenda tedavisinin ortostatik değişikliklerle ilişkili olmadığını göstermiştir.
Laboratuvar Değişiklikleri: Namenda ve plasebo grupları, (1) çeşitli serum kimyası, hematoloji ve idrar tahlili değişkenleri ve (2) bu hastalarda başlangıçtan itibaren potansiyel olarak klinik olarak önemli değişiklikler için kriterleri karşılayan hastaların görülme sıklığı değişkenler. Bu analizler Namenda tedavisi ile ilişkili laboratuvar test parametrelerinde klinik olarak önemli bir değişiklik göstermedi.
EKG Değişiklikleri: Namenda ve plasebo grupları (1) çeşitli EKG parametrelerinde başlangıçtan ortalama değişim ve (2) açısından karşılaştırıldı. bu hastalarda başlangıçtan itibaren potansiyel olarak klinik olarak önemli değişiklikler için kriterleri karşılayan hastaların görülme sıklığı değişkenler. Bu analizler, Namenda tedavisi ile ilişkili EKG parametrelerinde klinik olarak önemli bir değişiklik olmadığını ortaya koymuştur.
Klinik Araştırmalar Sırasında Gözlemlenen Diğer Olumsuz Olaylar
Namenda, 1200'den fazla önerilen 20 mg / gün dozunu alan yaklaşık 1350 demans hastasına uygulanmıştır. Hastalar 884 güne kadar Namenda tedavisi aldı, 862 hasta en az 24 hafta tedavi gördü ve 387 hasta 48 hafta veya daha fazla tedavi gördü.
8 kontrollü klinik çalışma ve 4 açık etiket sırasında ortaya çıkan tedavi belirti ve bulguları deneyler, klinik araştırmacılar tarafından kendi terminolojilerini kullanarak olumsuz olaylar olarak kaydedildi seçmek. Benzer olay türlerine sahip bireylerin oranına ilişkin genel bir tahmin sağlamak için olaylar gruplandırıldı DSÖ terminolojisi kullanılarak daha az sayıda standart kategoriye ayrıldı ve etkinlik sıklıkları çalışmaları.
Tablo 1'de listelenenler hariç olmak üzere, en az iki hastada meydana gelen tüm advers olaylar dahil edilmiştir, WHO terimleri de genel olarak bilgilendirici olmak, küçük semptomlar veya ilaca neden olması muhtemel olmayan olaylar, örneğin, bunlar çalışmada yaygın olduğu için nüfus. Olaylar vücut sistemine göre sınıflandırılır ve aşağıdaki tanımlar kullanılarak listelenir: sık görülen advers olaylar - en az 1/100 hastada meydana gelenler; seyrek advers olaylar - 1/100 ila 1/1000 hastada meydana gelenler. Bu advers olaylar mutlaka Namenda tedavisi ile ilişkili değildir ve çoğu durumda kontrollü çalışmalarda plasebo ile tedavi edilen hastalarda benzer sıklıkta gözlenmiştir.
Bir bütün olarak beden: Sık: senkop. Seyrek: hipotermi, alerjik reaksiyon.
Kardiyovasküler sistem: Sık: kalp yetmezliği. Seyrek: Anjina pektoris, bradikardi, miyokard enfarktüsü, tromboflebit, atriyal fibrilasyon, hipotansiyon, kardiyak arrest, postural hipotansiyon, pulmoner emboli, pulmoner ödem.
Merkezi ve Periferik Sinir Sistemi: Sık: geçici iskemik atak, serebrovasküler olay, vertigo, ataksi, hipokinezi. Seyrek: parestezi, konvülsiyonlar, ekstrapiramidal bozukluk, hipertoni, titreme, afazi, hipoestezi, anormal koordinasyon, hemipleji, hiperkinezi, istemsiz kas kasılmaları, stupor, serebral kanama, nevralji, pitoz, nöropati.
Mide bağırsak sistemi: Seyrek: gastroenterit, divertikülit, gastrointestinal kanama, melena, özofagus ülseri.
Hemik ve Lenfatik Bozukluklar: Sık: anemi. Seyrek: Lökopeni.
Metabolik ve Beslenme Bozuklukları: Sık: artan alkalin e fosfataz, kilo kaybı. Seyrek: dehidratasyon, hiponatremi, ağırlaştırılmış diyabetes mellitus.
Psikolojik bozukluklar: Sık: agresif reaksiyon. Seyrek: sanrı, kişilik bozukluğu, duygusal değişkenlik, sinirlilik, uyku bozukluğu, libido artışı, psikoz, amnezi, ilgisizlik, paranoid reaksiyon, anormal düşünme, anormal ağlama, iştah artışı, paroniria, deliryum, duyarsızlaşma, nevroz, intihar girişim.
Solunum sistemi: Sık: zatürree. Seyrek: apne, astım, hemoptizi.
Cilt ve Ekleri: Sık: döküntü. Seyrek: cilt ülseri, kaşıntı, selülit, egzama, dermatit, eritematöz döküntü, alopesi, ürtiker.
Özel Duyular: Sık: katarakt, konjonktivit. Seyrek: Makula lutea dejenerasyonu, görme keskinliğinde azalma, işitme azalması, kulak çınlaması, blefarit, bulanık görme, kornea opaklığı, glokom, konjonktival kanama, göz ağrısı, retina kanaması, kseroftalmi, diplopi, anormal lakrimasyon, miyopi, retina dekolmanı.
İdrar sistemi: Sık: sık işeme. Seyrek: dizüri, hematüri, idrar retansiyonu.
Hem ABD hem de ABD dışındaki Namenda'nın Pazarlanmasından Sonra Bildirilen Olaylar
Memantin tedavisi ile nedensel bir ilişki bulunmamasına rağmen, aşağıdaki advers olayların memantin tedavisi ile geçici olarak ilişkili olduğu ve etiketlemede başka yerlerde tarif edilmiştir: atriyoventriküler blok, kemik kırığı, karpal tünel sendromu, serebral enfarktüs, göğüs ağrısı, klodikasyon, kolit, diskinezi, disfaji, gastrit, gastroözofageal reflü, büyük mal konvülsiyonları, intrakraniyal kanama, hepatik yetmezlik, hiperlipidemi, hipoglisemi, ileus, iktidarsızlık, halsizlik, nöroleptik malign sendrom, akut pankreatit, aspirasyon pnömonisi, akut böbrek yetmezliği, uzamış QT aralığı, huzursuzluk, Stevens-Johnson sendromu, ani ölüm, supraventriküler taşikardi, taşikardi, geç diskinezi ve trombositopeni.
HAYVAN TOKSİKOLOJİSİ
Posterior kortikal tabaka III ve IV'te multipolar ve piramidal hücrelerde memantin kaynaklı nöronal lezyonlar (vakum ve nekroz) sıçanlarda, diğer NMDA reseptör antagonistleri uygulanan kemirgenlerde meydana geldiği bilinenlere benzer singulat ve retrosplenial neokorteksler. Lezyonlar tek bir doz memantin sonrası görüldü. Sıçanlara 14 gün boyunca günlük oral dozlarda memantin verildiği bir çalışmada, nöronal nekroz için etkisiz doz, mg / m2 bazında önerilen maksimum insan dozunun 6 katı idi. İnsanlarda NMDA reseptör antagonistleri tarafından merkezi nöronal vakumlama ve nekrozun indüklenme potansiyeli bilinmemektedir.
İLAÇ KULLANIMI VE BAĞIMLILIK
Kontrollü Madde Sınıfı: Memantin HC1 kontrollü bir madde değildir.
Fiziksel ve Psikolojik Bağımlılık: Memantin HC1, ilaç arayışına dair herhangi bir kanıt üretmeyen, düşük ila orta afiniteli, rekabetçi olmayan bir NMDA antagonistidir. terapötik klinik çalışmalara katılan 2.504 hastada kesilmesiyle ortaya çıkan davranış veya yoksunluk belirtileri dozlarda. ABD dışında, geriye dönük olarak toplanan pazarlama sonrası veriler, uyuşturucu bağımlılığı veya bağımlılığına dair bir kanıt sunmamıştır.
aşırı doz
Doz aşımı yönetimi için stratejiler sürekli olarak geliştiğinden, herhangi bir aşırı doz tedavisi için en son önerileri belirlemek için zehir kontrol merkezi ilaç.
Doz aşımı vakalarında olduğu gibi, genel destekleyici önlemler kullanılmalı ve tedavi semptomatik olmalıdır. Memantin eliminasyonu idrarın asitleştirilmesi ile arttırılabilir. 400 mg'a kadar memantin içeren belgelenmiş bir aşırı doz vakasında, hasta huzursuzluk, psikoz, görsel halüsinasyonlar, uyku hali, sersemlik ve bilinç kaybı yaşadı. Hasta kalıcı sekel olmadan iyileşti.
Dozaj ve Uygulama
Kontrollü klinik çalışmalarda etkili olduğu gösterilen Namenda'nın (memantin hidroklorür) dozu 20 mg / gündür.
Namenda'nın önerilen başlangıç dozu günde bir kez 5 mg'dır. Önerilen hedef doz 20 mg / gündür. Doz, 5 mg'lık artışlarla 10 mg / gün (günde iki kez 5 mg), 15 mg / gün (ayrı dozlar olarak 5 mg ve 10 mg) ve 20 mg / gün (günde iki kez 10 mg) arttırılmalıdır. Doz artışları arasında önerilen minimum aralık bir haftadır.
Namenda yemekle birlikte veya yemeksiz alınabilir.
Hastalar / bakıcılar Namenda Oral Solution dozlama cihazının nasıl kullanılacağı konusunda bilgilendirilmelidir. Ürünle birlikte verilen hasta talimat belgesinden haberdar edilmelidirler. Hastalar / bakıcılar, çözeltinin kullanımı ile ilgili soruları doktorlarına veya eczacılarına yöneltmelidir.
Özel Popülasyonlarda Dozlar
Şiddetli böbrek yetmezliği olan hastalarda (Cockroft-Gault denklemine göre 5 - 29 mL / dak. Kreatinin klerensi) hedef doz 5 mg BID önerilir:
Erkekler icin: CLcr = [140-yaş (yıl)] · Ağırlık (kg) / [72 · serum kreatinin (mg / dL)]
Kadınlar için: CLcr = 0.85 · [140-yaş (yıl)] · Ağırlık (kg) / [72 · serum kreatinin (mg / dL)]
Nasıl tedarik edildi
5 mg Tablet:
Şişe 60 NDC # 0456-3205-60
10 × 10 Birim Doz NDC # 0456-3205-63
Kapsül şeklindeki, film kaplı tabletler bronz renktedir, mukavemet (5) bir tarafta dökülür ve diğer tarafta FL bulunur.
10 mg Tablet:
Şişe 60 NDC # 0456-3210-60
10 × 10 Birim Doz NDC # 0456-3210-63
Kapsül şeklindeki, film kaplı tabletler gridir, mukavemet (10) bir tarafta dökülür ve diğer tarafta FL bulunur.
Titrasyon Pak:
49 tablet içeren PVC / Alüminyum Blister ambalaj. 28 ± 5 mg ve 21 ± 10 mg tablet. NDC # 0456-3200-14
5 mg kapsül şeklindeki, film kaplı tabletler bronz renktedir ve mukavemet (5) bir tarafta dökülürken, diğer tarafta FL bulunur. 10 mg kapsül şeklindeki, film kaplı tabletler gridir, mukavemet (10) bir tarafta dökülür ve diğer tarafta FL bulunur.
Oral Çözelti:
Oral çözelti için dozaj önerileri, tabletler için olanlarla aynıdır. Oral çözelti berrak, alkolsüz, şekersiz ve nane aromalıdır.
2 mg / mL Oral Çözelti (10 mg = 5 mL)
12 fl. oz. (360 mL) şişe NDC # 0456-3202-12
25 ° C'de (77 ° F) saklayın; 15-30 ° C'ye (59-86 ° F) izin verilen gezilere [bkz. USP Kontrollü Oda Sıcaklığı].
Orman Eczacılık A.Ş.
Forest Laboratories, Inc.'in iştiraki
St.Louis, MO 63045
Merz Pharmaceuticals GmbH lisanslıdır
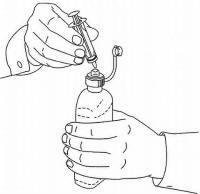
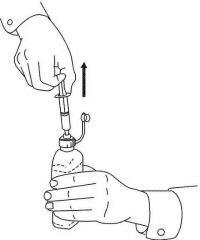
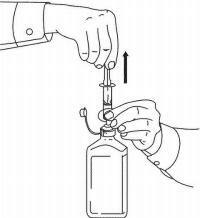
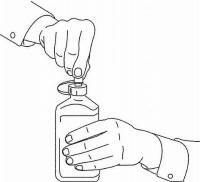
NAMENDA® Oral Solüsyon için HASTA TALİMATLARI
Namenda® Oral Solution dozlama cihazınızı kullanmak için aşağıdaki talimatları izleyin.
ÖNEMLİ: Namenda® Oral Solüsyonu kullanmadan önce bu talimatları okuyun.
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
ÖNEMLİ: Bu monograftaki bilgilerin olası tüm kullanımları, talimatları, önlemleri, ilaç etkileşimlerini veya yan etkileri kapsaması amaçlanmamıştır. Bu bilgiler genelleştirilmiştir ve özel tıbbi tavsiye olarak tasarlanmamıştır. Aldığınız ilaçlar hakkında sorularınız varsa veya daha fazla bilgi edinmek istiyorsanız, doktorunuza, eczacınıza veya hemşirenize danışın. Son güncelleme 4/07.
Kaynak: Forest Laboratories, Namenda'nın ABD distribütörü.
Namenda Hasta Bilgileri (normal İngilizce)
geri dön: Psikiyatrik İlaçlar Farmakoloji



