Diyabet Tedavisi için Starlix
Marka Adı: Starlix
Genel isim: nateglinid tabletleri
İçindekiler:
Açıklama
Klinik Farmakoloji
Klinik çalışmalar
Göstergeler ve kullanımları
Kontrendikasyonlar
Önlemler
Ters tepkiler
Doz Aşımı
Dozaj ve Uygulama
Nasıl tedarik edildi
Starlix, nateglinid, tam hasta bilgisi (Sade ingilizce)
Açıklama
Starlix® (nateglinid), Tip 2 diyabet mellitus [insüline bağımlı olmayan diabetes mellitus (NIDDM) veya yetişkin başlangıçlı diyabet olarak da bilinir) tedavisinde kullanılan oral antidiyabetik bir ajandır. Starlix, (-) - N - [(trans-4-izopropilsikloheksan) karbonil] -D-fenilalanin, oral sülfonilüre insülin salgılatıcıları ile yapısal olarak ilişkisizdir.
Yapısal formül gösterildiği gibidir
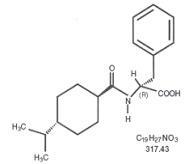
Nateglinid, moleküler ağırlığı 317.43 olan beyaz bir tozdur. Metanol, etanol ve kloroform içinde serbestçe çözünür, eter içinde çözünür, asetonitril ve oktanolde az çözünür ve pratik olarak suda çözünmez. Starlix bikonveks tabletler, oral uygulama için 60 mg veya 120 mg nateglinid içerir.
Aktif Olmayan Malzemeler: kolloidal silikon dioksit, kroskarmeloz sodyum, hidroksipropil metilselüloz, demir oksitler (kırmızı veya sarı), laktoz monohidrat, magnezyum stearat, mikrokristalin selüloz, polietilen glikol, povidon, talk ve titanyum dioksit.
üst
Klinik Farmakoloji
Hareket mekanizması
Nateglinid, pankreastan insülin sekresyonunu uyararak kan şekeri seviyelerini düşüren bir amino asit türevidir. Bu eylem, pankreas adacıklarındaki işlevsel beta hücrelerine bağlıdır. Nateglinid, pankreatik beta hücrelerinde ATP'ye duyarlı potasyum (K + ATP) kanalı ile etkileşir. Daha sonra beta hücresinin depolarizasyonu kalsiyum kanalını açar ve kalsiyum akışı ve insülin sekresyonu üretir. İnsülin salımının derecesi glikoza bağımlıdır ve düşük glikoz seviyelerinde azalır. Nateglinid, kalp ve iskelet kası için düşük afinite ile oldukça doku seçicidir.
Farmakokinetik
emme
Bir yemekten hemen önce oral uygulamayı takiben, nateglinid, dozlamadan sonra genellikle 1 saat içinde (Tmax) meydana gelen ortalama pik plazma ilaç konsantrasyonları (Cmax) ile hızla emilir. Tip 2 diyabetli hastalara günde üç kez 60 mg ila 240 mg dozaj aralığında uygulandığında haftada, nateglinid hem AUC (zaman / plazma konsantrasyon eğrisi altındaki alan) hem de lineer farmakokinetik gösterdi ve Cmax. Tmax'ın bu hasta popülasyonunda dozdan bağımsız olduğu da bulunmuştur. Mutlak biyoyararlanımın yaklaşık% 73 olduğu tahmin edilmektedir. Yemeklerle birlikte veya yemeklerden sonra verildiğinde, nateglinid emiliminin (EAA) derecesi etkilenmez. Bununla birlikte, emilim oranında bir gecikme, Cmax'ta bir azalma ve zirve plazma konsantrasyonuna (Tmax) kadar bir gecikme ile karakterize edilir. Plazma profilleri, nateglinid açlık koşulları altında uygulandığında çoklu plazma konsantrasyonu zirveleri ile karakterize edilir. Nateglinid bir yemekten önce alındığında bu etki azalır.
dağıtım
Nateglinidin intravenöz (IV) uygulamasını takiben verilere dayanarak, sağlıklı deneklerde nateglinidin kararlı durum dağılım hacminin yaklaşık 10 litre olduğu tahmin edilmektedir. Nateglinid, başta serum albümini olmak üzere serum proteinlerine ve daha az ölçüde Î ± 1 asit glikoproteine yoğun olarak (% 98) bağlanır. Serum protein bağlanma derecesi, 0.1-10 ug / mL test aralığı boyunca ilaç konsantrasyonundan bağımsızdır.
Metabolizma
Nateglinid, eliminasyondan önce karışık fonksiyonlu oksidaz sistemi tarafından metabolize edilir. Metabolizmanın ana yolları hidroksilasyon ve ardından glukuronid konjugasyonudur. Ana metabolitler, nateglinidden daha az güçlü antidiyabetik ajanlardır. İzopren minör metaboliti, ana bileşik nateglinidinkine benzer bir potansiyele sahiptir.
In vitro veriler, nateglinidin baskın olarak sitokrom P450 izoenzimleri CYP2C9 (% 70) ve CYP3A4 (% 30) tarafından metabolize olduğunu göstermektedir.
Boşaltım
Nateglinid ve metabolitleri oral uygulamayı takiben hızla ve tamamen ortadan kaldırılır. Dozlamadan sonraki 6 saat içinde, verilen 14C-nateglinidin yaklaşık% 75'i idrarda geri kazanılmıştır. 14C-nateglinidin yüzde seksen üçü idrarla atılır ve% 10 ek dışkıda atılır. 14C-nateglinidin yaklaşık% 16'sı ana bileşik olarak idrarla atılmıştır. Sağlıklı gönüllüler ve Tip 2 diyabetli hastaların tüm çalışmalarında, nateglinid plazma konsantrasyonları yaklaşık 1.5 saatlik ortalama eliminasyon yarılanma ömrü ile hızla düşmüştür. Bu kısa eliminasyon yarılanma ömrü ile uyumlu olarak, 7 gün boyunca günde üç kez 240 mg'a kadar çoklu dozlama üzerine belirgin bir nateglinid birikimi yoktu.
İlaç etkileşimleri
In vitro ilaç metabolizması çalışmaları, Starlix'in ağırlıklı olarak sitokrom P450 izozim CYP2C9 (% 70) ve daha az ölçüde CYP3A4 (% 30) tarafından metabolize olduğunu göstermektedir. Starlix, tolbutamidin in vitro metabolizmasını inhibe etme kabiliyeti ile belirtildiği gibi in vivo olarak CYP2C9 izoenziminin potansiyel bir inhibitörüdür. İn vitro deneylerde CYP3A4 metabolik reaksiyonlarının inhibisyonu saptanmadı.
Glyburide: Randomize, çok dozlu bir çapraz çalışmada, Tip 2 diyabetli hastalar gliburid 10 ile kombinasyon halinde yemeklerden önce günde üç kez 120 mg Starlix uygulandı 10 günlük mg. Her iki ajanın farmakokinetiğinde klinik olarak anlamlı bir değişiklik olmamıştır.
Metformin: Yemeklerden önce günde üç kez Starlix 120 mg, metformin 500 mg üç ile birlikte uygulandığında Tip 2 diyabetli hastalara günde iki kez, herhangi birinin farmakokinetiğinde klinik olarak anlamlı bir değişiklik yoktu ajan.
Digoksin: Yemeklerden 120 mg önce Starlix, tek bir 1 mg doz ile birlikte uygulandığında sağlıklı gönüllülere digoksin, herhangi bir farmakokinetiğinde klinik olarak anlamlı bir değişiklik yoktu ajan.
Warfarin: Sağlıklı deneklere dört gün boyunca yemeklerden önce günde üç kez Starlix 120 mg uygulandığında 2. günde 30 mg'lık tek bir warfarin dozu ile kombinasyon halinde, bunların farmakokinetiğinde herhangi bir değişiklik olmamıştır. ajan. Protrombin zamanı etkilenmedi.
Diklofenak: Starlix 120 mg sabah ve öğle yemeği dozlarının tek bir 75 mg ile kombinasyon halinde uygulanması sağlıklı gönüllülerde diklofenak dozu, herhangi birinin farmakokinetiğinde önemli bir değişiklikle sonuçlanmadı. ajan.
Özel Nüfuslar
Geriatrik: Yaş, nateglinidin farmakokinetik özelliklerini etkilememiştir. Bu nedenle, yaşlı hastalar için doz ayarlaması gerekli değildir.
Cinsiyet: Erkekler ve kadınlar arasında nateglinid farmakokinetiğinde klinik olarak anlamlı bir fark gözlenmemiştir. Bu nedenle, cinsiyete dayalı bir doz ayarlaması gerekli değildir.
Irk: Kafkas, Siyah ve diğer etnik kökenleri içeren popülasyon farmakokinetik analizinin sonuçları, ırkın nateglinidin farmakokinetiği üzerinde çok az etkisi olduğunu göstermektedir.
Böbrek yetmezliği: Sağlıklı eşleşen bireylerle karşılaştırıldığında Tip 2 diyabetli hastalar ve diyalizde olmayan orta-şiddetli böbrek yetmezliği (CrCl 15-50 mL / dak) benzer görünür temizleme, AUC ve Cmax. Tip 2 diyabetli ve diyalizde böbrek yetmezliği olan hastalar, genel ilaç maruziyetinde azalma göstermiştir. Bununla birlikte, hemodiyaliz hastaları, eşleşen sağlıklı gönüllülere kıyasla plazma proteinlerine bağlanmada azalmalar yaşamıştır.
Karaciğer Yetmezliği: Hafif karaciğer yetmezliği olan diyabetik olmayan hastalarda nateglinidin pik ve toplam maruziyeti, uyumlu sağlıklı gönüllülere kıyasla% 30 artmıştır. Kronik karaciğer hastalığı olan hastalarda Starlix® (nateglinid) dikkatle kullanılmalıdır. (Bkz. ÖNLEMLER, Karaciğer Yetmezliği.)
Farmakodinamik
Starlix hızla emilir ve oral uygulamadan sonra 20 dakika içinde pankreatik insülin sekresyonunu uyarır. Starlix yemeklerden önce günde üç kez dozlandığında, plazma insülininde hızlı bir artış olur, dozlamadan yaklaşık 1 saat sonra pik seviyeleri ve dozlamadan 4 saat sonra başlangıç seviyesine düşme.
Starlix'in her üçünden önce uygulandığı çift kör, kontrollü bir klinik çalışmada öğünler, plazma glikoz seviyeleri, 7 hafta sonra 12 saatlik, gündüz tedavisi. Starlix yemeklerden 10 dakika önce uygulandı. Yemekler, her bir kişinin boyuna göre toplam kalori içeriği ile standart diyabetik ağırlık bakım menülerine dayanıyordu. Starlix, plaseboya kıyasla açlık ve postprandiyal glisemide istatistiksel olarak anlamlı düşüşler üretti.
üst
Klinik çalışmalar
Starlix®'in (nateglinid) güvenliğini ve etkinliğini değerlendirmek için 8 ila 24 hafta süren dokuz çift kör, plasebo veya aktif kontrollü çalışmada toplam 3.566 hasta randomize edildi. 3.513 hastada başlangıç değerinin ötesinde etkinlik değerleri vardı. Bu çalışmalarda Starlix günde üç ana öğünden 30 dakika öncesine kadar uygulandı.
Plaseboya kıyasla Starlix® Monoterapisi
Randomize, çift kör, plasebo kontrollü, 24 haftalık bir çalışmada, HbA1C ile Tip 2 diyabetli hastalar â ‰ ¥% 6.8 sadece diyette Starlix (yemeklerden önce günde üç kez 60 mg veya 120 mg) veya plasebo almak için randomize edildi. Başlangıç HbA1C% 7.9 ila% 8.1 arasında değişiyordu ve hastaların% 77.8'ine daha önce oral antidiyabetik tedavi uygulanmamıştı. Daha önce antidiyabetik ilaçlarla tedavi edilen hastaların, randomizasyondan önce en az 2 ay boyunca bu ilacı bırakmaları gerekiyordu. Yemeklerden önce Starlix ilavesi, plaseboya kıyasla ortalama HbA1C ve ortalama açlık plazma glikozunda (FPG) istatistiksel olarak önemli azalmalar ile sonuçlandı (bkz. Tablo 1). HbA1C ve FPG'deki düşüşler, antidiyabetik ilaçlara sahip olmayan ve daha önce maruz kalmış hastalar için benzerdi.
Bu çalışmada, yemeklerden önce günde üç kez Starlix 120 mg ile tedavi edilen bir hastada bir şiddetli hipoglisemi (plazma glukoz <36 mg / dL) epizodu bildirilmiştir. Hiçbir hastada üçüncü taraf yardımı gerektiren hipoglisemi görülmedi. Starlix ile tedavi edilen hastalarda plaseboya kıyasla istatistiksel olarak anlamlı ortalama ağırlık artışları vardı (bkz. Tablo 1).
Randomize, çift kör, 24 haftalık, aktif ve plasebo kontrollü bir çalışmada, Tip 2 diyabetli hastalar Starlix'i almak için randomize edildi (üç kez 120 mg) yemeklerden önce günlük), metformin 500 mg (günde üç kez), Starlix 120 mg (yemeklerden önce günde üç kez) ve metformin 500 mg (günde üç kez) veya Plasebo. Başlangıç HbA1C% 8.3 ila% 8.4 arasında değişmiştir. Hastaların yüzde elli yedisi daha önce oral antidiyabetik tedavi ile tedavi edilmemiştir. Starlix monoterapisi, plaseboya kıyasla yukarıda bildirilen çalışmanın sonuçlarına benzer ortalama HbA1C ve ortalama FPG değerlerinde anlamlı azalmalar ile sonuçlandı (bkz. Tablo 2).
Tablo 1: Starlix® monoterapisinin 24 haftalık, sabit doz çalışması için son nokta sonuçları
|
plasebo |
Starlix® 60 mg üç kere günlük yemeklerden önce |
Starlix® 120 mg üç kere günlük yemeklerden önce |
|
| HbA1C (%) | N = 168 | N = 167 | N = 168 |
| Temel (ortalama) | 8.0 | 7.9 | 8.1 |
| Taban çizgisinden değişim (ortalama) | +0.2 | -0.3 | -0.5 |
| Plasebodan fark (ortalama) | -0.5 bir | -0.7 bir | |
| FPG (mg / dL) | N = 172 | N = 171 | N = 169 |
| Temel (ortalama) | 167.9 | 161.0 | 166.5 |
| Taban çizgisinden değişim (ortalama) | +9.1 | +0.4 | -4.5 |
| Plasebodan fark (ortalama) | -8.7 bir | -13.6 bir | |
| Ağırlık (kg) | N = 170 | N = 169 | N = 166 |
| Temel (ortalama) | 85.8 | 83.7 | 86.3 |
| Taban çizgisinden değişim (ortalama) | -0.7 | +0.3 | +0.9 |
| Plasebodan fark (ortalama) | +1.0 bir | +1.6 bir |
bir p değeri â ‰ ¤ 0,004
Diğer Oral Antidiyabetik Ajanlara Göre Starlix® Monoterapisi
Gliburid'in
24 haftalık, çift kör, aktif kontrollü bir çalışmada, Tip 2 diyabetli hastalar, 3 aydır sülfonilüre olmuş ve 3 aydır başlangıçta HbA1C vardı -% 6.5% Starlix (günde üç kez yemeklerden önce 60 mg veya 120 mg) veya bir kez 10 mg gliburid almak için randomize edildi günlük. Starlix'e randomize edilen hastalar, gliburide randomize edilen hastalara kıyasla son noktadaki ortalama HbA1C ve ortalama FPG'de anlamlı artışlara sahipti.
Metformin
Randomize, çift kör, 24 haftalık, aktif ve plasebo kontrollü bir çalışmada, Tip 2 diyabetli hastalar Starlix'i almak için randomize edildi (üç kez 120 mg) yemeklerden önce günlük), metformin 500 mg (günde üç kez), Starlix 120 mg (yemeklerden önce günde üç kez) ve metformin 500 mg (günde üç kez) veya Plasebo. Başlangıç HbA1C% 8.3 ila% 8.4 arasında değişmiştir. Hastaların yüzde elli yedisi daha önce oral antidiyabetik tedavi ile tedavi edilmemiştir. Metformin monoterapisi ile son noktadaki ortalama HbA1C ve ortalama FPG'deki düşüşler, Starlix monoterapisi ile bu değişkenlerdeki azalmalardan önemli ölçüde daha büyüktü (bakınız Tablo 2). Plaseboya göre, Starlix monoterapisi ortalama ağırlıkta önemli artışlarla, metformin monoterapisi ortalama ağırlıkta önemli azalmalar ile ilişkili bulunmuştur. Antidiyabetik tedaviye açık hasta alt grupları arasında ortalama HbA1C ve Starlix monoterapisi için ortalama FPG'deki düşüşler metformin monoterapisine benzerdi (bkz. Tablo 2). Daha önce Starlix'te gliburit, HbA1C gibi diğer antidiyabetik ajanlarla tedavi edilen hasta alt kümesi arasında monoterapi grubu taban çizgisinden hafifçe artarken, metformin monoterapi grubunda HbA1C azalmıştır (bkz. Tablo 2).
Starlix® Kombinasyon Terapisi
Metformin
Randomize, çift kör, 24 haftalık, aktif ve plasebo kontrollü bir çalışmada, Tip 2 diyabetli hastalar Starlix'i almak için randomize edildi (üç kez 120 mg) yemeklerden önce günlük), metformin 500 mg (günde üç kez), Starlix 120 mg (yemeklerden önce günde üç kez) ve metformin 500 mg (günde üç kez) veya Plasebo. Başlangıç HbA1C% 8.3 ila% 8.4 arasında değişmiştir. Hastaların yüzde elli yedisi daha önce oral antidiyabetik tedavi ile tedavi edilmemiştir. Daha önce antidiyabetik ilaçlarla tedavi edilen hastaların, randomizasyondan önce en az 2 ay boyunca ilacı bırakmaları gerekiyordu. Starlix ve metformin kombinasyonu, HbA1C ve FPG'de Starlix veya metformin monoterapisine kıyasla istatistiksel olarak önemli ölçüde daha fazla azalma ile sonuçlandı (bkz. Tablo 2). Starlix, tek başına veya metformin ile kombinasyon halinde, prandiyal glikoz yükselmesini, tek başına plasebo ve metformine kıyasla, yemek öncesi ila 2 saat sonra önemli ölçüde azalttı.
Bu çalışmada, bir hastada şiddetli hipoglisemi (plazma glikozu â ‰ ¤ 36 mg / dL) atak bildirilmiştir. metforminde bir hastada Starlix ve metformin kombinasyonu ve dört şiddetli hipoglisemi atağı bildirildi tedavi kolu. Hiçbir hastada üçüncü taraf yardımı gerektiren bir hipoglisemi atağı yaşanmadı. Plasebo ile karşılaştırıldığında, Starlix monoterapisi ağırlıkta istatistiksel olarak anlamlı bir artış ile ilişkilendirildi, kombine Starlix ve metformin tedavisi ile ağırlıkta anlamlı bir değişiklik gözlenmedi (bakınız Tablo 2).
Başka bir 24 haftalık, çift kör, plasebo kontrollü çalışmada, metformin ile tedaviden sonra HbA1C ile â ‰ ¥% 6.8 Tip 2 diyabetli hastalar (â ‰ ¥ 1 ay boyunca günlük â ‰ ¥ 1500 mg) girildi Metformin monoterapisi (günde 2000 mg) dört haftalık bir alıştırma periyoduna dönüştürüldü ve daha sonra metformine ek olarak Starlix (yemeklerden önce günde üç kez 60 mg veya 120 mg) veya plasebo almak için randomize edildi. Starlix ve metformin ile kombinasyon tedavisi, HbA1C, metformin monoterapisine kıyasla (Starlix 60 mg ve Starlix 120 mg artı metformin için% -0.4 ve -0.6, sırasıyla).
Tablo 2: 24 haftalık Starlix® monoterapisi ve metformin ile kombinasyon çalışması için son nokta sonuçları
|
plasebo |
Starlix® 120 mg üç kere her gün önce yemekler |
Metformin 500 mg üç kere günlük |
Starlix® 120 mg önce yemekler artı Metformin * |
|
| HbA1C (%) | ||||
| Herşey | N = 160 | N = 171 | N = 172 | N = 162 |
| Temel (ortalama) | 8.3 | 8.3 | 8.4 | 8.4 |
| Taban çizgisinden değişim (ortalama) | +0.4 | -0.4 M.Ö | -0.8 c | -1.5 |
| Plasebodan fark | -0.8 bir | -1.2 bir | -1.9 bir | |
| Nan-ve | N = 98 | N = 99 | N = 98 | N = 81 |
| Temel (ortalama) | 8.2 | 8.1 | 8.3 | 8.2 |
| Taban çizgisinden değişim (ortalama) | +0.3 | -0.7 c | -0.8 c | -1.6 |
| Plasebodan fark | -1.0 bir | -1.1 bir | -1.9 bir | |
| Sigara-nan-ve | N = 62 | N = 72 | N = 74 | N = 81 |
| Temel (ortalama) | 8.3 | 8.5 | 8.7 | 8.7 |
| Taban çizgisinden değişim (ortalama) | +0.6 | +0.004 M.Ö | -0.8 c | -1.4 |
| Plasebodan fark | -0.6 bir | -1.4 bir | -2.0 bir | |
| FPG (mg / dL) | ||||
| Herşey | N = 166 | N = 173 | N = 174 | N = 167 |
| Temel (ortalama) | 194.0 | 196.5 | 196.0 | 197.7 |
| Taban çizgisinden değişim (ortalama) | +8.0 | -13.1 M.Ö | -30.0 c | -44.9 |
| Plasebodan fark | -21.1 bir | -38.0 bir | -52.9 bir | |
| Ağırlık (kg) | ||||
| Herşey | N = 160 | N = 169 | N = 169 | N = 160 |
| Temel (ortalama) | 85.0 | 85.0 | 86.0 | 87.4 |
| Taban çizgisinden değişim (ortalama) | -0.4 | +0.9 M.Ö | -0.1 | +0.2 |
| Plasebodan fark | +1.3 bir | +0.3 | +0.6 |
p değeri â ‰ ¤ 0,05'e karşı plasebo
b p değeri â ‰ ¤ 0,03 vs. metformin
c p değeri â ‰ ¤ 0,05'e karşı kombinasyon
* Metformin günde üç kez uygulandı
Rosiglitazon
Tip 2 olan hastalara 24 haftalık, çift kör çok merkezli, plasebo kontrollü bir çalışma yapıldı rosiglitazon monoterapisine terapötik bir yanıttan sonra diyabet yeterince kontrol edilmedi 8 mg günlük. Starlix ilavesi (yemeklerle günde üç kez 120 mg), HigA1C'de rosiglitazon monoterapisine kıyasla istatistiksel olarak önemli ölçüde daha fazla azalma ile ilişkilendirildi. Fark 24. haftada% -0.77 idi. Başlangıçtaki ortalama ağırlık değişikliği, Starlix artı rosiglitazon ile tedavi edilen hastalarda yaklaşık +3 kg, plasebo artı rosiglitazon ile tedavi edilen hastalarda yaklaşık +1 kg idi.
Gliburid'in
Tip 2 diyabetli hastaların 12 haftalık bir çalışmasında günde bir kez 10 mg gliburid üzerinde yetersiz kontrol edilmesi, Starlix ilavesi (yemeklerden önce günde üç kez 60 mg veya 120 mg) herhangi bir ek üretmedi yarar.
üst
Göstergeler ve kullanımları
Starlix® (nateglinid), tip 2 diyabetes mellituslu yetişkinlerde glisemik kontrolü geliştirmek için diyet ve egzersize ek olarak endikedir.
üst
Kontrendikasyonlar
Starlix® (nateglinid) aşağıdakileri olan hastalarda kontrendikedir:
1. İlaca veya inaktif bileşenlerine karşı bilinen aşırı duyarlılık.
2. Tip 1 diyabet.
3. Diyabetik ketoasidoz. Bu durum insülin ile tedavi edilmelidir.
üst
Önlemler
Makrovasküler Sonuçlar: Starlix veya başka herhangi bir antidiyabetik ilaç ile makrovasküler risk azaltımına dair kesin kanıtlar sunan hiçbir klinik çalışma yapılmamıştır.
Hipoglisemi: Sistemik olarak emilen tüm oral kan şekerini düşüren ilaçlar hipoglisemi üretebilir. Hipoglisemi sıklığı diyabetin şiddeti, glisemik kontrol seviyesi ve diğer hasta özellikleri ile ilişkilidir. Geriatrik hastalar, yetersiz beslenen hastalar ve adrenal veya hipofiz yetmezliği veya ciddi böbrek yetmezliği olan hastalar bu tedavilerin glikoz düşürücü etkisine daha duyarlıdır. Hipoglisemi riski, ağır fiziksel egzersiz, alkol alımı, akut veya kronik bazda yetersiz kalori alımı veya diğer oral antidiyabetiklerle kombinasyonlar ajanlar. Otonom nöropatili ve / veya beta-bloker kullanan hastalarda hipogliseminin fark edilmesi zor olabilir. Hipoglisemi riskini azaltmak için Starlix® (nateglinid) yemeklerden önce uygulanmalıdır. Yemekleri atlayan hastalar ayrıca hipoglisemi riskini azaltmak için planlanan Starlix dozunu atlamalıdır.
Karaciğer Yetmezliği: Starlix, orta ila şiddetli karaciğer hastalığı olan hastalarda dikkatle kullanılmalıdır, çünkü bu tür hastalar çalışılmamıştır.
Glisemik Kontrol Kaybı
Ateş, enfeksiyon, travma veya cerrahi ile geçici glisemik kontrol kaybı meydana gelebilir. Bu zamanlarda Starlix tedavisi yerine insülin tedavisi gerekebilir. İkincil arıza veya belirli bir süre boyunca Starlix'in etkinliğinde azalma olabilir.
Hastalar için Bilgiler
Hastalar, Starlix'in potansiyel riskleri ve yararları ve alternatif tedavi yöntemleri hakkında bilgilendirilmelidir. Hipogliseminin riskleri ve yönetimi açıklanmalıdır. Hastalara bir öğünü yutmadan önce Starlix'i 1 ila 30 dakika almaları, ancak öğünü atlamaları durumunda hipoglisemi riskinin azaltılması için planlanan dozlarını atlamaları talimatı verilmelidir. İlaç etkileşimleri hastalarla tartışılmalıdır. Hastalar, Starlix ile potansiyel ilaç-ilaç etkileşimleri hakkında bilgilendirilmelidir.
Laboratuvar testleri
Tedavilere yanıt, glikoz değerleri ve HbA1C seviyeleri ile periyodik olarak değerlendirilmelidir.
İlaç etkileşimleri
Nateglinid, ağırlıklı olarak albümin olmak üzere plazma proteinlerine (% 98) yüksek oranda bağlanır. Furosemid, propranolol, kaptopril, nikardipin, pravastatin gibi yüksek oranda proteine bağlı ilaçlarla in vitro yer değiştirme çalışmaları, gliburit, varfarin, fenitoin, asetilsalisilik asit, tolbutamid ve metformin, nateglinid proteininin boyutu üzerinde hiçbir etki göstermedi bağlayıcı. Benzer şekilde, nateglinidin propranolol, gliburit, nikardipin, warfarin, fenitoin, asetilsalisilik asit ve tolbutamidin in vitro serum protein bağlanmasına etkisi yoktu. Bununla birlikte, klinik vakalarda bireysel vakaların ihtiyatlı değerlendirilmesi gerekmektedir.
Steroid olmayan antienflamatuar ajanlar (NSAID'ler), salisilatlar, monoamin oksidaz inhibitörleri ve seçici olmayan beta-adrenerjik bloke edici ajanlar Starlix ve diğer oral antidiyabetiklerin hipoglisemik etkisini güçlendirebilir ilaçlar.
Tiazidler, kortikosteroidler, tiroid ürünleri ve sempatomimetikler gibi bazı ilaçlar Starlix ve diğer oral antidiyabetik ilaçların hipoglisemik etkisini azaltabilir.
Bu ilaçlar Starlix alan hastalara uygulandığında veya bu hastalardan çekildiğinde, hasta glisemik kontrolde değişiklikler açısından yakından izlenmelidir.
İlaç / Gıda Etkileşimleri
Nateglinidin farmakokinetiği, bir öğünün bileşiminden (yüksek protein, yağ veya karbonhidrat) etkilenmemiştir. Bununla birlikte, sıvı bir yemekten 10 dakika önce Starlix uygulandığında pik plazma seviyeleri önemli ölçüde azaldı. Asetaminofen testi ile değerlendirilen Starlix'in sağlıklı deneklerde mide boşalması üzerinde herhangi bir etkisi yoktur.
Kanserojenez / Mutajenez / Doğurganlık Bozukluğu
Kanserojenite: Sprague-Dawley sıçanlarında iki yıllık bir kanserojenlik çalışması, 900 mg / kg / güne kadar oral dozlarda nateglinid ile gerçekleştirildi ve AUC maruziyeti üretildi. erkek ve dişi sıçanlarda, insan terapötik maruziyetinin yaklaşık 30 ve 40 katı, sırasıyla günde üç kez önerilen 120 mg'lık Starlix dozu ile yemekler. B6C3F1 farelerinde iki yıllık bir kanserojenlik çalışması, 400 mg / kg / gün'e kadar oral nateglinid dozlarıyla gerçekleştirildi ve erkeklerde AUC maruziyeti üretildi ve dişi fareler, insanlara terapötik maruziyetin yaklaşık 10 ila 30 katı, önerilen Starlix dozu 120 mg, yemeklerden önce günde üç kez. Sıçanlarda veya farelerde tümörjenik bir yanıt kanıtı bulunamadı.
Mutajenez: Nateglinid, in vitro Ames testinde, fare lenfoma testinde, Çin hamster akciğer hücrelerinde kromozom aberasyon testinde veya in vivo fare mikronükleus testinde genotoksik değildi.
Doğurganlık Bozukluğu: Doğurganlık, sıçanlara 600 mg / kg'a kadar olan dozlarda nateglinidin uygulanmasından etkilenmemiştir. (günde üç kez 120 mg önerilen Starlix dozu ile insan terapötik maruziyetinin yaklaşık 16 katı Yemekler).
Gebelik
Gebelik Kategorisi C
Nateglinid, sıçanlarda 1000 mg / kg'a kadar olan dozlarda teratojenik değildi (yemeklerden önce günde üç kez, önerilen 120 mg'lık Starlix dozu ile insan terapötik maruziyetinin yaklaşık 60 katı). Tavşanlarda embriyonik gelişim olumsuz etkilenmiş ve safra kesesi agenezi veya küçük safra kesesi insidansı 500 mg / kg doz (günde üç kez önerilen 120 mg'lik Starlix dozu ile insan terapötik maruziyetinin yaklaşık 40 katı Yemekler). Gebe kadınlarda yeterli ve iyi kontrollü çalışma yoktur. Starlix hamilelik sırasında kullanılmamalıdır.
Emek ve Teslimat
Starlix'in insanlarda doğum ve doğum üzerindeki etkisi bilinmemektedir.
Emziren Anneler
Emziren sıçanlarda yapılan çalışmalar, nateglinidin sütün içine atıldığını gösterdi; sütteki plazmaya AUC0-48h oranı yaklaşık 1: 4'tür. Peri ve postnatal dönemde 1000 mg / kg'da nateglinid uygulanan sıçanlarda vücut ağırlıkları daha düşüktü. (günde üç kez önerilen 120 mg'lık Starlix dozuyla insanın terapötik maruziyetinin yaklaşık 60 katı Yemekler). Starlix'in anne sütüne geçip geçmediği bilinmemektedir. Birçok ilaç anne sütüne geçtiği için, Starlix emziren bir kadına uygulanmamalıdır.
Pediyatrik Kullanım
Pediatrik hastalarda Starlix'in güvenliği ve etkinliği belirlenmemiştir.
Geriyatrik Kullanım
65 yaş ve üstü ile 65 yaşın altındaki hastalar arasında Starlix'in güvenliği veya etkinliği açısından hiçbir fark gözlenmemiştir. Bununla birlikte, bazı yaşlı bireylerin Starlix tedavisine daha fazla duyarlılığı göz ardı edilemez.
üst
Ters tepkiler
Klinik çalışmalarda, Tip 2 diyabetli yaklaşık 2.600 hasta Starlix® (nateglinid) ile tedavi edildi. Bunlardan yaklaşık 1.335 hasta 6 ay veya daha uzun ve yaklaşık 190 hasta bir yıl veya daha uzun süre tedavi edildi.
Hipoglisemi, klinik çalışmaların tüm tedavi kollarında nispeten nadirdi. Starlix hastalarının sadece% 0.3'ü hipoglisemi nedeniyle kesildi. Gastrointestinal semptomlar, özellikle ishal ve bulantı, Starlix ve metformin kombinasyonunu kullanan hastalarda sadece metformin alan hastalardan daha yaygın değildi. Benzer şekilde, periferal ödem, Starlix ve rosiglitazon kombinasyonunu kullanan hastalarda tek başına rosiglitazon alan hastalardan daha yaygın değildi. Aşağıdaki tablo, kontrollü klinik çalışmalarda Starlix hastalarında plasebo hastalarından daha sık meydana gelen olayları listelemektedir.
Starlix® Monoterapi Denemelerinde Yaygın Olumsuz Olaylar (Starlix® hastalarında â ‰ ¥% 2) (hastaların yüzdesi)
| plasebo | Starlix® | |
| N = 458 | = 1441 K | |
| Tercih Edilen Terim | ||
| Üst solunum yolu enfeksiyonu | 8.1 | 10.5 |
| Sırt ağrısı | 3.7 | 4.0 |
| Grip Belirtileri | 2.6 | 3.6 |
| Baş dönmesi | 2.2 | 3.6 |
| artropati | 2.2 | 3.3 |
| İshal | 3.1 | 3.2 |
| Kazayla Travma | 1.7 | 2.9 |
| Bronşit | 2.6 | 2.7 |
| Öksürme | 2.2 | 2.4 |
| hipoglisemi | 0.4 | 2.4 |
Pazarlama sonrası deneyim sırasında, döküntü, kaşıntı ve ürtiker gibi nadiren aşırı duyarlılık reaksiyonları bildirilmiştir. Benzer şekilde sarılık, kolestatik hepatit ve karaciğer enzimlerinde artış bildirilmiştir.
Laboratuvar Anormallikleri
Ürik Asit: Tek başına Starlix, metformin, tek başına metformin ve sadece gliburit ile kombinasyon halinde Starlix ile tedavi edilen hastalar için ortalama ürik asit düzeylerinde artışlar vardı. Plasebodan ilgili farklılıklar 0.29 mg / dL, 0.45 mg / dL, 0.28 mg / dL ve 0.19 mg / dL idi. Bu bulguların klinik önemi bilinmemektedir.
üst
Doz Aşımı
Tip 2 diyabetli hastalarda yapılan bir klinik çalışmada, Starlix® (nateglinid) 7 gün boyunca günde 720 mg'a kadar artan dozlar ve klinik olarak önemli yan etkiler yoktu bildirildi. Klinik çalışmalarda Starlix ile aşırı doz vakası olmamıştır. Bununla birlikte, aşırı doz, hipoglisemik semptomların gelişmesiyle aşırı glikoz düşürücü etkiye neden olabilir. Bilinç kaybı veya nörolojik bulguları olmayan hipoglisemik semptomlar oral glikoz ve dozaj ve / veya yemek düzenlerindeki ayarlamalar ile tedavi edilmelidir. Koma, nöbet veya diğer nörolojik semptomlarla şiddetli hipoglisemik reaksiyonlar intravenöz glikoz ile tedavi edilmelidir. Nateglinid yüksek oranda proteine bağlı olduğundan, diyaliz kandan uzaklaştırılmasında etkili bir araç değildir.
üst
Dozaj ve Uygulama
Starlix® (nateglinid) yemeklerden 1 ila 30 dakika önce alınmalıdır.
Monoterapi ve Metformin veya Tiazolidindion ile Kombinasyon
Starlix'in önerilen başlangıç ve idame dozu, tek başına veya metformin veya tiazolidindion ile kombinasyon halinde, yemeklerden önce günde üç kez 120 mg'dır.
Tek başına veya metformin veya tiazolidindion ile kombinasyon halinde 60 mg'lık Starlix dozu, tedavi başlatıldığında HbA1C hedefine yakın hastalarda kullanılabilir.
Geriatrik Hastalarda Dozaj
Genellikle özel bir doz ayarlaması gerekmez. Bununla birlikte, bazı kişilerin Starlix tedavisine daha fazla duyarlılığı göz ardı edilemez.
Böbrek ve Karaciğer Yetmezliğinde Dozaj
Hafif ila şiddetli böbrek yetmezliği olan hastalarda veya hafif karaciğer yetmezliği olan hastalarda doz ayarlamasına gerek yoktur. Orta ila şiddetli hepatik disfonksiyonu olan hastaların dozlanması çalışılmamıştır. Bu nedenle, Starlix orta ila şiddetli karaciğer hastalığı olan hastalarda dikkatli kullanılmalıdır (ÖNLEMLER, Karaciğer Yetmezliği).
üst
Nasıl tedarik edildi
Starlix® (nateglinid) tabletleri
60 mg
Pembe, yuvarlak, eğimli kenarlı tablet, bir tarafta "Starlix", diğer tarafta "60"
100 şişe... NDC 0078-0351-05
120 mg
Bir tarafta "Starlix" ve diğer tarafta "120" şeklinde sarı, ovaloid tablet.
100 şişe... NDC 0078-0352-05
Depolama
25ºC'de (77ºF) saklayın; 15ºC-30ºC'ye (59ºF-86ºF) izin verilir.
Sıkı bir kapta dağıtın, USP.
T2008-01
REV: TEMMUZ 2008
Tarafından üretildi:
Novartis Pharma Stein AG
Stein, İsviçre
Tarafından dağıtıldı:
Novartis İlaç Şirketi
Doğu Hannover, New Jersey 07936
© Novartis
Son Güncelleme 07/2008
Starlix, nateglinid, tam hasta bilgisi (Sade ingilizce)
Diyabetin Belirtileri, Belirtileri, Nedenleri, Tedavileri Hakkında Detaylı Bilgi
Bu monograftaki bilgilerin olası tüm kullanımları, talimatları, önlemleri, ilaç etkileşimlerini veya yan etkileri kapsaması amaçlanmamıştır. Bu bilgiler genelleştirilmiştir ve özel tıbbi tavsiye olarak tasarlanmamıştır. Aldığınız ilaçlar hakkında sorularınız varsa veya daha fazla bilgi edinmek istiyorsanız, doktorunuza, eczacınıza veya hemşirenize danışın.
geri dön: Diyabet için tüm İlaçlara göz atın



